
【题目】下列关于化学电源的叙述错误的是( )
A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO2的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]强热可发生反应:3K4[Fe(CN)6] ![]() 2 (CN)2↑+12KCN+N2↑+Fe3C+C
2 (CN)2↑+12KCN+N2↑+Fe3C+C
(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态核外电子排布式为 .
(2)(CN)2分子中碳原子杂化轨道类型为;1mol(CN)2分子中含有σ键的数目为 .
(3)O ![]() 与CN﹣互为等电子体,则O
与CN﹣互为等电子体,则O ![]() 的电子式为 .
的电子式为 .
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH+SO2=Na2SO3+H2O …(a)
Na2SO3+H2O+SO2=2NaHSO3…(b)
2NaHSO3 ![]() Na2S2O5+H2O …(c)
Na2S2O5+H2O …(c)
实验装置如下: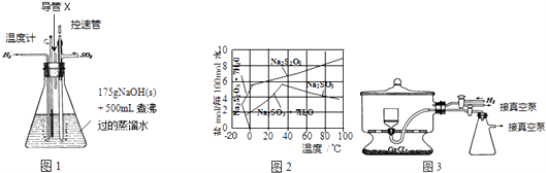
(1)实验室可用废铝丝与NaOH溶液反应制取H2 , 制取H2的离子方程式为 .
(2)图1装置中,导管X的作用是 .
(3)通氢气一段时间后,以恒定速率通入SO2 , 开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为;
实验后期须保持温度在约80℃,可采用的加热方式为 .
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图2溶解度曲线,除去其中亚硫酸钠固体的方法是;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 .
(5)用图3装置干燥Na2S2O5晶体时,通入H2的目的是;真空干燥的优点是 .
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S2O52﹣+2I2+3H2O=2SO42﹣+4I﹣+6H+;2S2O32﹣+I2=S4O62﹣+2I﹣
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na2S2O3溶液滴定至接近终点.
④ .
⑤ .
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( ) ①已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 , 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 ![]() (g)+3H2(g)→
(g)+3H2(g)→ ![]() (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A.①②③④
B.③④⑤
C.④⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含K+、Al3+、NH4+、SO42﹣ . 取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体.在滤液中通入过量的CO2 , 经过滤、洗涤、灼烧,称重得到0.51g固体2.原溶液中K+的浓度为( )
A.0.08mol/L
B.0.04mol/L
C.0.02mol/L
D.0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3 , 还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2═4AlCl3+3O2
回答以下问题:
(1)加入焦炭后的化学反应可表示为Al2O3+C+Cl2 ![]() AlCl3+X↑,设计实验确定气体X的成分: .
AlCl3+X↑,设计实验确定气体X的成分: .
(2)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2 , 从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为 .
(3)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①过程涉及的离子方程式、 .
②AlCl3产品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.NaOH、Mg(OH)2.、Al(OH)3的碱性逐渐减弱
B.Si、P、S、Cl原子半径逐渐减小
C.C、N、O、F最高正价逐渐减弱
D.K、Na、Mg、Al金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。
A.粉末状态的煤比块状煤的着火点低
B.粉末状态的煤比块状煤放出的热量多
C.粉末状态的煤比块状煤的总表面积大
D.粉末状态的煤呈气态,属于可燃性气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com