
【题目】(12分)现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
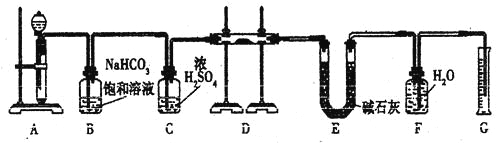
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 。
(2)装置B的作用是 。
装置C的作用是 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
【答案】6 mol·L-1盐酸 除去气体中的HCl 干燥气体 吸收装置D中反应剩余的CO2 2Na2O2+2CO2=2Na2CO3+O2、 Na2O+CO2=Na2CO3 78%
【解析】
试题(1)根据装置图可知,A装置是制备CO2的,所以应该选择6mol/L盐酸,而不能选择硫酸。这是由于硫酸与CaCO3反应生成微溶的CaSO4,覆盖在CaCO3表面,使反应终止。
(2)盐酸易挥发,则生成的CO2中含有氯化氢气体,则装置B的作用是除去气体中的HCl;CO2在反应中是过量的,所以装置E中碱石灰的作用是吸收未反应的CO2。
(3) CO2进入装置D中和氧化钠、过氧化钠分别反应,则装置D中发生反应的化学方程式是2Na2O2+2CO2===2Na2CO3+O2、 Na2O+CO2===Na2CO3。
(4)设试样中Na2O2的质量为χg,依题意可知:
2Na2O2+2CO2===2Na2CO3+O2
2×78 22.4 L
χ 0.224 L
解得χ="1.56"
![]()


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是
A. X和Y的氧化物都是可导致酸雨的污染物
B. Z和W形成的化合物中既有离子键又有共价键
C. 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X
D. 原子半径由大到小的顺序:r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子反应:M2O7x-+3S2﹣+14H+=2M3++3S↓+7H2O其中x值和M2O7x-离子中M化合价分别是______和______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X(g)+3Y(g) ![]() 2Z(g) ΔH=-akJ·mol-1。一定条件下将1 molX 和3 molY通入2 L的恒容密闭容器中,反应10 min时,测得Y的物质的量为2.4 mol。下列说法正确的是
2Z(g) ΔH=-akJ·mol-1。一定条件下将1 molX 和3 molY通入2 L的恒容密闭容器中,反应10 min时,测得Y的物质的量为2.4 mol。下列说法正确的是
A. 在10 min内,X和Y反应放出的热量为0.3 a kJ
B. 在l0min时,X和Z的物质的量之比为1:2
C. 达到平衡状态时,X、Y的浓度不再改变
D. 升髙反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法不正确的是

A. 当+6价铬足量且pH大于7时,等质量的FeSO4的除铬量比NaHSO3高
B. 若选用NaHSO3处理含铬污水时,不能将污水的酸性调节的过强
C. pH>8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 选择FeSO4做处理剂更有利于Cr(OH)3的沉降及分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是

A. 用①所示的操作可检查装置的气密性
B. 用②所示的装置制取少量的NO
C. 用③所示的装置干燥H2、NH3、CO2等
D. 用④所示装置制取Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com