
����Ŀ�������[��NH4)2C2O4] Ϊ��ɫ��״���壬���ȶ� �������ֽ⣬�����ڲⶨ Ca2+��Mg2+�ĺ�����
I.ijͬѧ������ͼ��ʾʵ��װ�ü������淋ķֽ���
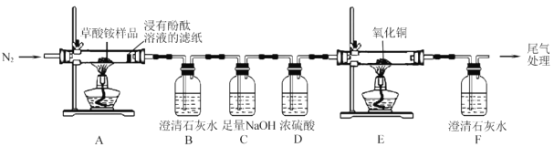
��1��ʵ������У��۲쵽���з�̪��Һ����ֽ��죬װ�� B �г���ʯ��ˮ����ǣ�˵���ֽ�����к���__________________���ѧʽ�������۲쵽__________________��˵���ֽ�����к��� CO������立ֽ�Ļ�ѧ����ʽΪ______________________��
��2����Ӧ��ʼǰ ��ͨ�뵪����Ŀ����________________________��
��3��װ�� C ��������_______________________��
��4������һ�ַֽ������һ��������Ҳ�ܻ�ԭCuO , �÷�Ӧ�Ļ�ѧ����ʽΪ__________��
II.��ͬѧ���ò���鱗ⶨѪҺ�и�Ԫ�صĺ��� ��
��5��ȡ 20.00 mL ѪҺ��Ʒ �������� l00m L, �ֱ�ȡ���������Ϊ25.00 mL ϡ�ͺ��ѪҺ��Ʒ���������泥����ɲ���Ƴ��������ˣ����ó������ڹ���ϡ�����У�Ȼ���� 0.0l00mol/L KMnO4 ��Һ���еζ����ζ����յ�ʱ��ʵ������Ϊ___________�����εζ�ʵ������ KMnO4 ��Һ������ֱ�Ϊ0.43mL , 0.41 m L , 0.52mL, ���ѪҺ��Ʒ�и�Ԫ�صĺ���Ϊ________m mol/L��
���𰸡�![]() ��
��![]() װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ�����
װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ����� 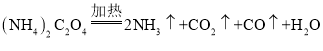 �ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�
�ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ�� ����
����ʵ�� ����![]() �������CO�ļ����������
�������CO�ļ����������  ���������һ��
���������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 2.10
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 2.10
��������
I���������A�����ȷֽ⣬���������а�����������ˮ��Ӧ���ɰ�ˮ����ˮ�Լ��ԣ�����з�̪��Һ����ֽ��죬ͨ�����ʯ��ˮ��������ʯ��ˮ����ǣ�������ж�����̼����NaOH��Һ��ȥ������̼����Ũ�����ȥˮ���������������������ڱ�죬��F�г���ʯ��ˮ�������֤����������CO��
II�������ӺͲ�����������ɲ���Ƴ���������ƺ����ᷴӦ��������ƺͲ��ᣬ�ø�����صζ�����Ӷ���ӵζ������ӡ�
��.��1��ʵ������У��۲쵽���з�̪��Һ����ֽ��Ϊ��ɫ˵���ֽ�����к��а�����װ��B�г���ʯ��ˮ����ǣ�˵���ֽ�����к��ж�����̼���壬���۲쵽װ��E������ͭ�ɺ�ɫ��Ϊ��ɫ��װ��F�г���ʯ��ˮ����ǣ�˵���ֽ�����к���CO�����Բ���立ֽ������![]() ��
��![]() ��CO��
��CO��![]() ����Ӧ�Ļ�ѧ����ʽΪ
����Ӧ�Ļ�ѧ����ʽΪ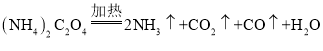 ��
��
��2����Ӧ��ʼǰ��ͨ�뵪����Ŀ�����ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ��,�ʴ�Ϊ���ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�
����ʵ��,�ʴ�Ϊ���ž�װ���ڵĿ���������CO�������ϼ��ȷ�����ը������ֹ�����е�![]() ����ʵ�飻
����ʵ�飻
��3��װ��E��F����֤����立ֽ�����к���CO������Ҫ�ѷֽ������![]() ��ȥ�����װ��C�������ǣ�����
��ȥ�����װ��C�������ǣ�����![]() �������CO�ļ���������ţ��ʴ�Ϊ������
�������CO�ļ���������ţ��ʴ�Ϊ������![]() �������CO�ļ���������ţ�
�������CO�ļ���������ţ�
��4������立ֽ������![]() �л�ԭ�ԣ�һ��������Ҳ����CuO��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ
�л�ԭ�ԣ�һ��������Ҳ����CuO��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��
��![]() �����Ը��������Һ�ζ���������ӣ���������������ԭ��Ӧ����ɫ�ĸ��������Һ����ɫ���ζ����յ�ʱ��ʵ������Ϊ�����������һ��
�����Ը��������Һ�ζ���������ӣ���������������ԭ��Ӧ����ɫ�ĸ��������Һ����ɫ���ζ����յ�ʱ��ʵ������Ϊ�����������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ���������εζ��������Ը��������Һ�������֪����������һ������������̫�����������������ε�ƽ�����Ϊ
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ���������εζ��������Ը��������Һ�������֪����������һ������������̫�����������������ε�ƽ�����Ϊ![]() ������������ԭ��Ӧ�еĵ����غ㼰Ԫ���غ㣬��
������������ԭ��Ӧ�еĵ����غ㼰Ԫ���غ㣬��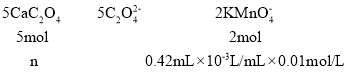 �����
�����![]() ������20mLѪҺ��Ʒ�к��еĸ�Ԫ�ص����ʵ���Ϊ
������20mLѪҺ��Ʒ�к��еĸ�Ԫ�ص����ʵ���Ϊ![]() ����
����![]() �����ѪҺ�и�Ԫ�صĺ���Ϊ
�����ѪҺ�и�Ԫ�صĺ���Ϊ![]() ���ʴ�Ϊ�����������һ��
���ʴ�Ϊ�����������һ��![]() ��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��
��Һʱ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⣨Mo������Ҫ��;���������ָ֣���CO��ԭMoO3����ɫ��ĩ������ʱ��ƣ��Ʊ�����Mo��װ����ͼ������˵����ȷ����

A.װ�â���ʢ�б���Na2CO3��Һ��װ�â���ʢ��Ũ���ᣬ�����Ǿ���CO2
B.װ�â��е�ϡ�������ϡ������棬ʯ��ʯ����̼���Ʒ�ĩ����
C.װ�âܵ��������Ʊ�CO��װ�âݵ�������CO��ԭMoO3
D.װ�â��ܴﵽ����MoO3�Ƿ�CO��ԭ��Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ����Ҫ���л��ϳ��м��壬���ĺϳ�·����ͼ��
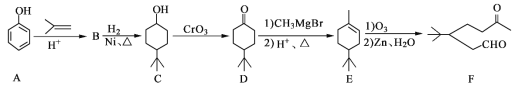
��1��������F�к��������ŵ�������______��______����A����B�Ļ�ѧ��Ӧ������______��
��2��д��������B�Ľṹ��ʽ��______��
��3��д��������C�����ᷴӦ�������Ļ�ѧ����ʽ��______��
��4��ij��������D��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�����Ľṹ��ʽ��______����дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�����߲ˡ�����Ʒ�и�����ά����C�������ԵĿ�˥�����ã����ױ�����������ij����С�����õ�ζ�����ij��֭��ά����C�ĺ������仯ѧ����ʽ��ͼ��ʾ������˵���в���ȷ����

A.������ӦΪ������ԭ��Ӧ
B.�ζ�ʱ���õ�����Һ��ָʾ��
C.�ζ�ʱӦ��������ƿʹ��Ӧ���
D.����ά����C�ķ���ʽΪC6H6O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2��CH4��Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ���ͼ�������ЧӦ������Ҫ�����塣��ҵ��CO2��CH4������ӦI��CH4(g)+CO2(g)��2CO(g)+2H2(g) ��H1
�ڷ�Ӧ�����л�������Ӧ����H2(g)+CO2(g)��H2O(g)+CO(g)��H2=+41kJ/mol
(l)��֪���ֻ�ѧ���ļ����������±���ʾ��
��ѧ�� | C��H | H��H | C=O |
|
���ܣ�kJ/mol�� | 413 | 436 | 803 | 1076 |
����Hl =____kJ/mol����Ӧ����һ���������ܹ��Է����е�ԭ����____���÷�Ӧ��ҵ�������˵��¶Ⱥ�ѹǿΪ____�����ţ���
A.���¸�ѹ B�����µ�ѹ C�����¸�ѹ D�����µ�ѹ
(2)��ҵ�Ͻ�CH4��CO2�����ʵ���1:1Ͷ����ȡCO2��H2ʱ��CH4��CO2��ƽ��ת�������¶ȱ仯��ϵ��ͼ��ʾ��
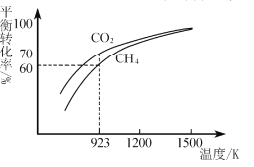
��923KʱCO2��ƽ��ת���ʴ���CH4��ԭ����________________________
�ڼ���923Kʱ��ӦII�Ļ�ѧƽ�ⳣ��K=______������������С�������λ����
��1200K����CO2��CH4��ƽ��ת����������ȵ�ԭ�������____��
(3)��ҵ��CH4��CO2��Ӧʱͨ�������O2������Ӧ
III: CH4+2O2��CO2+2H2O������O2��������Ӧ�����Ļ�̼�ͼ�С��Ӧ�����ȸ��ɣ���λʱ����ά�ַ�Ӧ�������蹩������������O2�Ľ������뷴Ӧ���ȸ��ɵĹ�ϵ��ͼ��ʾ��
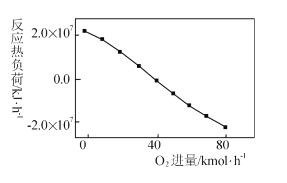
������O2�����������ӣ��ȸ����½���ԭ���� ____��
�ڲ���O2��ʹCH4��ƽ��ת����____������������������С����������������ͬ����CO2��ƽ��ת����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�ͷ�����װ��ʾ����ͼ��a��b��c�ֱ�Ϊʯ�ͷ����Ʒ������˵����ȷ����

A. ��a��b��c��������У�a���۵����
B. �����Ʒ�ķе㣺a>b>c>���ͣ�����
C. ��a��b��c��������У�c��ƽ����Է����������
D. a��b��c�����͡����Ͷ��Ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A.����������Һ�У�Na+��Cu2+��NO3-��Cl-
B.������Һ�У�Fe3+��NH4+��Br-��HCO3-
C.c(OH-)<![]() ����Һ�У�Na+��Ca2+��ClO-��F-
����Һ�У�Na+��Ca2+��ClO-��F-
D.1 mol/L��KNO3��Һ�У�H+��Fe2+��SCN-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ���£������ʵ����ĸ����ʷֱ���Na��NaOH��NaHCO3ǡ�÷�Ӧʱ������Na��NaOH��NaHCO3�����ʵ���֮��Ϊ�� ��
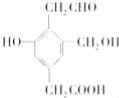
A��3��2��1 B��3��3��2 C��1��1��1 D��3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���춡�ᣭ3��������( )��һ�����ϣ���ͼ���������ϵ�һ�ֺϳ�·�ߣ�
)��һ�����ϣ���ͼ���������ϵ�һ�ֺϳ�·�ߣ�

��֪������Ϣ��
���л���E��Ħ������Ϊ88 g��mol��1����˴Ź������ױ�������3�ֲ�ͬ��������ԭ�ӡ�
���л���F�DZ��״���ͬϵ�
��R��CH==CH2![]() R��CH2CH2OH��
R��CH2CH2OH��
��ش��������⣺
(1)�춡�ᣭ3���������ķ���ʽΪ________________��
(2)A�����еĹ���������Ϊ________________��
(3)C�Ľṹ��ʽΪ________________��
(4)һ�������£�1 mol D��2 mol H2�ܹ���ȫ��Ӧ����F��D�ܹ�����������Ӧ�����D����F�ķ�Ӧ����Ϊ________________��
(5)E��F��Ӧ�����춡�ᣭ3���������Ļ�ѧ����ʽΪ________________________��
(6)��֪�л��������������������
����F��ͬ���칹�壻�ڱ�������3��֧�����ۺ˴Ź���������ʾ�京��5�ֲ�ͬ��������ԭ�ӣ��Ҳ�ͬ��������ԭ�Ӹ�����Ϊ6��2��2��1��1������FeCl3��Һ���ܷ�����ɫ��Ӧ��
д�����������������л���Ľṹ��ʽ��_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com