
【题目】根据侯氏制碱原理是:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓,2NaHCO3![]() Na2CO3+H2O+CO2↑,实验室利用侯氏制碱原理制备少量NaHCO3的实验,需要经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
Na2CO3+H2O+CO2↑,实验室利用侯氏制碱原理制备少量NaHCO3的实验,需要经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
A. B.
B.
C. D.
D.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是______________________________

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:

则x=______
(3)若HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在农药、制药行业中用途广泛,沸点为77℃,遇水剧烈反应,液面上产生白雾,并产生带有刺激性气味的气体。实验室用干燥的Cl2和SO2与SCl2反应合成SOCl2,反应原理是:SO2+Cl2+SCl2=2SOCl2。回答以下问题:
Ⅰ.氯化亚砜的制备
实验室拟用以下装置完成氯化亚砜的制备:
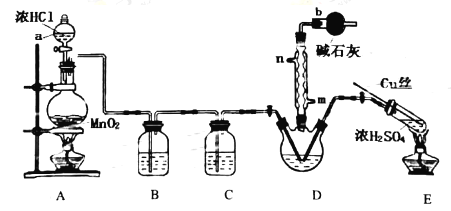
(1)仪器a的名称是__;装置D中冷凝管的冷凝水入口是__。
(2)装置A中反应的离子方程式__;装置E中反应的化学方程式__。
(3)B、C所盛试剂分别是__、__;装置D中干燥管b的作用是__。
(4)本实验的主要副产物是SCl2,已知:SOCl2沸点为77℃,SCl2的沸点为50℃,提纯SOCl2的实验操作是__;
Ⅱ.氯化亚的性质与检测
经分析,某实验小组的同学认为,SOCl2与水反应后的溶液中有盐酸和亚硫酸生成。
(5)欲证明SOCl2与水反应后形成的溶液中有H2SO3生成,可以使用的试剂是__;欲证明纯净SOCl2与水反应后形成的溶液中有Cl-,实验的操作方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是 ( )
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是 ( )
A.Ra元素位于元素周期表中第六周期ⅡA族B.RaCl2的熔点比CaCl2高
C.一个![]() 原子中含有138个中子D.Ra(OH)2是一种两性氢氧化物
原子中含有138个中子D.Ra(OH)2是一种两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素位于短周期内,它们的原子序数依次递增。A原子核内仅有一个质子,B原子的电子总数与D原子最外层电子数相等。D原子最外层电子数是其电子层数的3倍。由此推断:
(1)A与D组成化合物中,含有非极性键的分子的电子式为___________
(2)B与D组成的化合物中,属于非极性分子的电子式为____________
(3)A与C组成的化合物分子式的电子式为____________属于_____分子。(填“极性”或“非极性”)
(4)已知A、B、C、D可组成一种化合物,且原子个数比8 :1 :2 :3该化合物的化学式为_______属于_____化合物(填“离子”或“共价”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是____。
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)![]() 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①向某容器中充入1.0molH2O(g)和1.0molCO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
0 | 5min | 10min | 15min | 20min | 25min | |
Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是_____。
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图像正确且能说明可逆反应已达到平衡状态的是_____(填字母)。
A.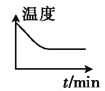 B.
B. C.
C.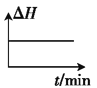 D.
D.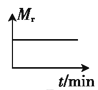
(4)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是___。若有标准状况下11.2LN2生成,共消耗ClO2___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com