
 【化学一选修3:物质结构与性质】
【化学一选修3:物质结构与性质】| 元素 | X | Y | Z |
| 电负性 | 1.5 | 1.2 | 1.8 |
| 第一电离能(kJ/mol) | 578 | 738 | 787 |
| 第二电离能(kJ/mol) | 1817 | 1451 | 1577 |
| 第三电离能(kJ/mol) | 2745 | 7733 | 3232 |
| 第四电离能(kJ/mol) | 11575 | 10540 | 4355 |
| M |
| Vm |
2
| ||
| 3 |
2
| ||
| 3 |
2
| ||
| 3 |
| M |
| Vm |
| 55 | ||||||
|
| 1.2 |
| a3 |
| 1.2 |
| a3 |


科目:高中化学 来源: 题型:
 锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、充电时电极a连接电源的负极 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、放电时左侧电解质储罐中的离子总浓度增大 |
| D、阳离子交换膜可阻止Br2与Zn直接发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol?L-1 |
| B、1 mol?L-1 |
| C、2mol?L-1 |
| D、0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
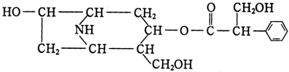
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g?cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
| 双氧水 |
| 稀硫酸 |
| 试剂A |
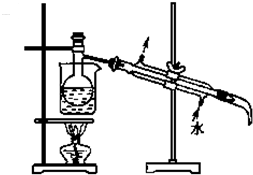
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | ××× |
| 配料 | ①食用油 ②盐 ③辣椒 ④苯甲酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| D、当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com