
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() 。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
A.该溶液中所含的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
C.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
D.若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,3.4g NH3含N—H 键0.2 NA
B.标准状况下,1.4g N2、CO混合气体体积约为1.12 L
C.常温常压下,100 mL 0.1mol·L—1的过氧化氢水溶液中含氢原子的数目为0.02 NA
D.常温常压下,0.1 mol·L-1CH3COONa溶液中,c(CH3COO—)小于0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是_________。
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
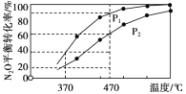
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是_________(选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是_________。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是________,请用原子结构理论解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L己烯中含有碳氢键数目为12NA
B.100g质量分数17%H2O2溶液中极性键数目为NA
C.65gZn与一定量的浓硫酸完全反应得混合气体的分子数为NA
D.电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制480mL 0.1mol/L的CuCl2溶液,实际操作步骤有:
①在天平上称量一定量的CuCl2,放入烧杯,加水溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)称量CuCl2的总质量是______;
(2)操作步骤的正确顺序是(填序号)________;
(3)本实验使用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______;
(4)若没有进行④操作,会使结果(填偏高、偏低或无影响,下同)_____;
(5)若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com