
 如图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )
如图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )| A、标准液盐酸的浓度为0.1 mol/L |
| B、NaOH溶液的浓度为0.05 mol/L |
| C、滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D、指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| c(标准)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、50mL 0.5 mol?L-1的NaCl溶液 |
| B、0.5 L含0.2 mol?L-1的MgCl2溶液 |
| C、10mL0.4 mol?L-1的AlCl3溶液 |
| D、100mL1.0 mol?L-1的KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol/L |
| B、0.20 mol/L |
| C、0.25 mol/L |
| D、0.40 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉、胆矾都属于混合物 |
| B、氧化铝、氯化钠都属于离子化合物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、二氧化硫、二氧化氮都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B、等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C、HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)-C(OH-)=C(CN-)-C(Na+) |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (5)下列关于化合物I、II、V、VI的说法正确的有
(5)下列关于化合物I、II、V、VI的说法正确的有查看答案和解析>>
科目:高中化学 来源: 题型:
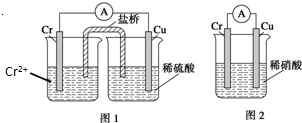 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)?N2O4(g);△H<0 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 上层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com