
【题目】在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g。
求:(1)此混合气体中CO和CO2的物质的量各为多少?___________________
(2)混合气体缓慢通过足量的澄清石灰水后,剩余的气体是什么?其质量为多少?其所含电子数为多少?________________
【答案】0.4mol 0.2molCO 11.2g 5.6NA
【解析】
(1)标准状况下:n总=![]() =
=![]() =0.6mol,设CO的物质的量为x,CO2的物质的量为y,①28g/mol×x+44g/mol×y=20g,②x+y=0.6mol,①②联立解得:x=0.4mol,y=0.2mol;答:混合气体中CO的物质的量是0.4mol,CO2的物质的量是0.2mol;
=0.6mol,设CO的物质的量为x,CO2的物质的量为y,①28g/mol×x+44g/mol×y=20g,②x+y=0.6mol,①②联立解得:x=0.4mol,y=0.2mol;答:混合气体中CO的物质的量是0.4mol,CO2的物质的量是0.2mol;
(2)由于CO2和氢氧化钙反应,所以剩余的气体是CO,m(CO)=n(CO)×M(CO)=0.4mol×28g/mol=11.2g,1个CO含有14个电子,所含电子数为0.4mol×14×6.02×1023mol-1=5.6×6.02×1023,答:剩余的气体是CO,其质量为11.2g,所含电子数为5.6×6.02×1023。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. 共价化合物可能含有离子键
B. CCl4和NH3都是只含有极性键的共价化合物
C. Na2O2是含有非极性键的离子化合物
D. CaO和NaCl晶体熔化时要破坏离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性,物质![]() 有光学活性,发生下列反应后生成的产物有光学活性的是( )
有光学活性,发生下列反应后生成的产物有光学活性的是( )
A. 与NaOH水溶液共热 B. 与银氨溶液作用
C. 与乙酸发生酯化反应 D. 在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中共有18个纵行,但仅有15个族
C.原子的核外电子层数等于该元素所在的周期数
D.原子最外层电子数等于该元素所在的族序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为____________,若得溶液密度为1.0g/cm3,则溶液中含HCl质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________________;配制过程中,造成浓度偏低的操作可能有________________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E.定容时,俯视液面加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡状态的说法中正确的是( )
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
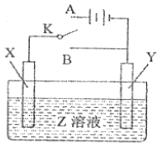
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为铜片,Y为铁片,Z为CuSO4,将开关K置于A处可实现在铁片上镀铜
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为NaOH,将开关K置于A处,Y极发生的反应为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类是广泛存在于植物和动物体内的天然有机化合物,薄荷酵(![]() )和香茅醇(
)和香茅醇( )是两种常见的萜类化合物,有关这两种化合物的说法中正确的是
)是两种常见的萜类化合物,有关这两种化合物的说法中正确的是
A. 薄荷醇环上的一溴代物有5种(不考虑立体异构)
B. 薄荷醇和香茅醇一定条件下都能与乙酸发生取代反应
C. 利用酸性高锰酸钾溶液可鉴别薄荷醇和香茅醇
D. 等质量的香茅醇和薄荷醇完全燃烧,薄荷醇消耗的氧气多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com