
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
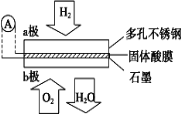
A. b 极上的电极反应式为:O2+2H2O+4e-=4OH-
B. 每转移0.1mol电子,消耗1.12L的H2
C. H+由a极通过固体酸电解质传递到b极
D. 电子通过外电路从b极流向a极
【答案】C
【解析】
根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L。
A、该电池为酸性电池,b极电极反应式为O2+4e-+4H+=2H2O,选项A错误;
B、因没有说明是否为标准状况,则消耗氢气的体积不一定为1.12L,选项B错误;
C、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,选项C正确;
D、因氢元素的化合价升高,则a为负极,电子应该是通过外电路由a极流向b极,选项D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2
B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解
D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为_____;用O2表示这段时间该化学反应速率为______。
(3)用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A.活性炭的质量保持不变 B.v正(N2)=2v逆(NO)
C.容器内气体压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
(4)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
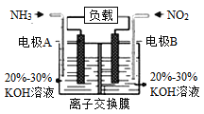
①A电极的电极反应式为_______________。
②下列关于该电池的说法正确的是___________(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极
B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液
C. 当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上,对过氧化氢的分子结构有过不同观点,下图两种对结构的猜测中有一种正确,请选用合理实验加以证明
猜想Ⅰ: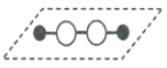 猜想Ⅱ:
猜想Ⅱ: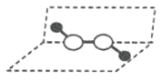
A.测定过氧化氢的沸点
B.测定过氧化氢分解时吸收的能量
C.测定过氧化氢分子中的氢氧键与氧氧键键长
D.观察过氧化氢细液流在电场中是否发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学反应的离子方程式书写正确的是( )
A. H2CO3电离:H2CO3![]() CO32-+2H+
CO32-+2H+
B. 将少量金属钠放入冷水中:Na+2H2O=Na+ +2OH-+H2↑
C. C12溶解于水:Cl2+H2O![]() 2H++ClO- +Cl-
2H++ClO- +Cl-
D. 向CuSO4溶液中通入H2S:Cu2+ +H2S=CuS↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中:互为同分异构体的是___,互为同系物的是__,属于同一种物质的是___。
A.CH3CH2CH3、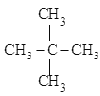 B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.
B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.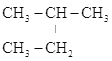 、
、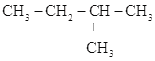 E.CH3CH2CH2COOH、CH3COOCH2CH3
E.CH3CH2CH2COOH、CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Cu 组成的2.64g固体混合物投入适量稀稍酸中恰好完全反应,收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为( )
A. 8.96LB. 0.896LC. 4.48LD. 0.448L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:______________。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:________。
(3)工业上制漂白粉的化学方程式为____________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________。
(4)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是有机合成工业中一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)实验室制氯气的离子方程式为_________________________氯气溶于水生成的次氯酸的电子式为__________________________
(2)AlCl3可以作净水剂,其原理是(用离子方程式表示) ___________________________
(3)Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其离子方程式为________________
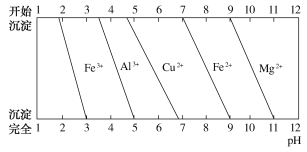
(4)为分析某铝合金的成分,用足量稀硝酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为5、9时过滤沉淀,继续滴加NaOH溶液无沉淀生成。结合图象信息推断该合金中除铝外还含有的金属是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com