
【题目】氰气的化学式为![]() ,结构式为
,结构式为![]() ,性质与卤素相似,下列有关叙述正确的是( )
,性质与卤素相似,下列有关叙述正确的是( )
A.氰气分子中既有极性键,又有非极性键
B.氰气分子中![]() 键的键长大于
键的键长大于![]() 键的键长
键的键长
C.氰气分子中含有2个![]() 键和4个
键和4个![]() 键
键
D.氰气不能和氢氧化钠溶液发生反应
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是
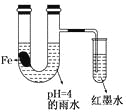
A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
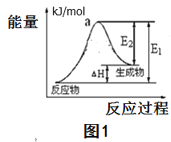
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:
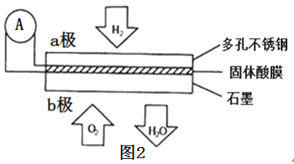
①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F可作为内燃机的润滑油,聚合物![]() (
(![]() )用于制备水凝胶,它们的合成路线如下:
)用于制备水凝胶,它们的合成路线如下:
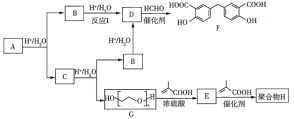
已知:![]() +(n-1)H2O
+(n-1)H2O
nCH2=CH2+nCH2=CHCH3![]()
![]()
(1)![]() 的分子式为
的分子式为![]() ,
,![]() 的化学名称是_________。红外光谱测定结果显示,
的化学名称是_________。红外光谱测定结果显示,![]() 中不含羟基。
中不含羟基。![]() 的反应类型是_____________。
的反应类型是_____________。
(2)![]() 的化学方程式是__________________。
的化学方程式是__________________。
(3)反应![]() 的另一种产物是
的另一种产物是![]() ,其相对分子质量是60,
,其相对分子质量是60,![]() 均能与
均能与![]() 溶液反应产生
溶液反应产生![]() 。
。
①![]() 的结构简式是_______________________。
的结构简式是_______________________。
②![]() 的化学方程式是________________________。
的化学方程式是________________________。
(4)下列说法正确的是_________________。
a.![]() 中均含有酯基
中均含有酯基
b.![]() 中所有碳原子一定在同一平面上
中所有碳原子一定在同一平面上
c.![]() 的同分异构体中能使
的同分异构体中能使![]() 溶液显色的共有1l种
溶液显色的共有1l种
(5)写出由乙烯和甲苯合成![]() 的路线:______________(其他试剂任选)。
的路线:______________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
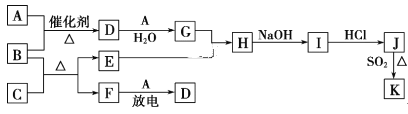
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为__;F的结构式为__。
(2)A与B生成D的反应在工业上是生产__的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为__。
(4)B和C反应的化学方程式为__。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
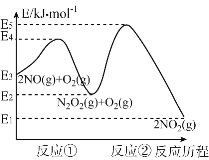
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
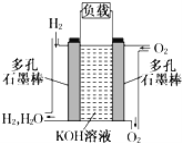
(1)图中通过负载的电子流动方向__(填“向左”或“向右”)。
(2)写出氢氧燃料电池工作时正极电极反应方程式。__。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极电极反应方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com