
【题目】对于反应:K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O ,若有0.1mol K2Cr2O7参加反应,下列说法正确的是( )
A.被氧化的HCl为51.1molB.转移电子1.806×1023个
C.氧化产物为7.3gD.还原剂占参加反应HCl的![]()
【答案】D
【解析】
A. K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,HCl中Cl化合价升高,被氧化,虽然14molHCl参与反应,但只有6molHCl作还原剂,若有0.1mol K2Cr2O7参加反应,则有0.6mol的HCl被氧化,故A错误;
B. 根据A选项,0.6molHCl被氧化,每个Cl化合价升高1价,因此失去了0.6mol×1=0.6mol电子,因此转移电子0.6NA = 3.612×1023个,故B错误;
C. 氯气是化合价升高得到的产物,因此为氧化产物,K2Cr2O7 —3Cl2,根据关系得到氧化产物物质的量为0.3mol,质量为0.3mol×71gmol1 = 21.3g,故C错误;
D. 14mol盐酸参与反应,有6mol盐酸作还原剂,因此还原剂占参加反应HCl的![]() ,故D正确。
,故D正确。
综上所述,答案为D。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 电极丁的反应式为MnO42- -e-= MnO4-
B. 电极乙附近溶液的pH减小
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中流过2 mol电子时,理论上有2molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸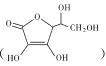 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A. ![]()
B. 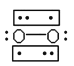
C. ![]()
D. 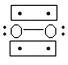
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为 N2(g)+3H2(g) ![]() 2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJmol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )
①苯的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1mol苯最多与3molH2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
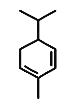
⑤CH2=CH2与CH2=CH-CH=CH2互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦所有卤代烃都能发生水解反应
A.①②⑤B.①④⑦C.③⑤⑥D.③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+ 和Cu2+的装置如右图。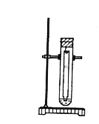
以下叙述错误的是
A.该方法为径向纸上层析法B.试样点晾干后才能补滴
C.试样点不能接触展开剂D.可喷KSCN溶液检验分离出来的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.电解饱和食盐水时,若生成11.2LCl2,则生成H2分子的数目为0.5NA
B.28g分子式为CnH2n的链烃中含有的共用电子对数目为6NA
C.1mol晶体硅中含有的共价键数目为4NA
D.87gMnO2与100mL12mol·L-1的浓盐酸共热,转移电子数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com