
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题
(1)FeCl3溶液呈酸性原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)> c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为________________________。(填序号)
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
【答案】Fe 3++3H2O![]() Fe(OH)3+3H+ Fe2O3 = ④>①>②>③ MgO[或Mg(OH)2、MgCO3]等 4×10-8 1.2×10-4
Fe(OH)3+3H+ Fe2O3 = ④>①>②>③ MgO[或Mg(OH)2、MgCO3]等 4×10-8 1.2×10-4
【解析】
(1)FeCl3溶液呈酸性的原因是Fe3+发生水解生成Fe(OH)3和H+;若把FeCl3溶液蒸干、灼烧,水解生成的HCl挥发,Fe(OH)3分解,由此可得最后得到固体产物的成分。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合,发生反应HA+NaOH=NaA+H2O,此时溶液中c(HA)=c(A-),测得混合溶液中c(Na+)> c(A-),则表明溶液中以A-水解为主,依据物料守恒,可得出c(HA)+c(A-)与0.1 mol·L-1的关系。
(3)浓度均为0.1 mol/L的四种溶液
①氯化铵溶液中,NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
②碳酸氢铵溶液中,NH4HCO3=NH4++HCO3-,NH![]() + HCO3-+H2O
+ HCO3-+H2O![]() NH3·H2O + H2CO3;
NH3·H2O + H2CO3;
③氨水中,NH3·H2O![]() NH
NH![]() + OH-;
+ OH-;
④硫酸氢铵中,NH4HSO4=NH4++H++SO42-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
以①中氯化铵溶液为参照,依据NH4+所在环境对NH4+的促进或抑制,确定浓度由大到小的顺序。
(4)①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入镁的氧化物、氢氧化物、碳酸盐等,调节溶液的pH=4,此时c(OH-)=10-10mol/L,代入Ksp[Fe(OH)3]=4×10-38,求溶液中的c(Fe3+)。
②常温下,利用Ksp[Mg(OH)2]=1.8×10-11,求0.01 mol·L-1 MgCl2溶液有沉淀生成时,所需NaOH溶液的浓度。
(1)FeCl3溶液呈酸性的原因是Fe3+发生水解生成Fe(OH)3和H+,反应的离子方程式为Fe 3++3H2O![]() Fe(OH)3+3H+;若把FeCl3溶液蒸干、灼烧,水解生成的HCl挥发,Fe(OH)3分解,最后得到固体产物为Fe2O3。答案为:Fe 3++3H2O
Fe(OH)3+3H+;若把FeCl3溶液蒸干、灼烧,水解生成的HCl挥发,Fe(OH)3分解,最后得到固体产物为Fe2O3。答案为:Fe 3++3H2O![]() Fe(OH)3+3H+;Fe2O3;
Fe(OH)3+3H+;Fe2O3;
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合,发生反应HA+NaOH=NaA+H2O,此时溶液中c(HA)=c(A-)=0.05 mol·L-1,测得混合溶液中c(Na+)> c(A-),则表明溶液中以A-水解为主,依据物料守恒,可得出c(HA)+c(A-)= 2×0.05 mol·L-1=0.1 mol·L-1。答案为:=;
(3)①氯化铵溶液中,NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
②碳酸氢铵溶液中,NH4HCO3=NH4++HCO3-,NH![]() + HCO3-+H2O
+ HCO3-+H2O![]() NH3·H2O + H2CO3,由于HCO3-水解反应的促进,c(NH
NH3·H2O + H2CO3,由于HCO3-水解反应的促进,c(NH![]() )比①中小;
)比①中小;
③氨水中,NH3·H2O![]() NH
NH![]() + OH-,由于电离程度较小,所以溶液中c(NH
+ OH-,由于电离程度较小,所以溶液中c(NH![]() )比②中小;
)比②中小;
④硫酸氢铵中,NH4HSO4=NH4++H++SO42-,NH![]() +H2O
+H2O![]() NH3·H2O + H+,由于H+的抑制作用,溶液中c(NH
NH3·H2O + H+,由于H+的抑制作用,溶液中c(NH![]() )比①中大;
)比①中大;
依据上述分析,c(NH![]() )由大到小的顺序为④>①>②>③。答案为:④>①>②>③;
)由大到小的顺序为④>①>②>③。答案为:④>①>②>③;
(4)①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入MgO[或Mg(OH)2、MgCO3]等;溶液的pH=4,此时c(OH-)=10-10 mol·L-1,代入Ksp[Fe(OH)3]=4×10-38,求得溶液中的c(Fe3+)=![]() =4×10-8 mol·L-1。答案为:MgO[或Mg(OH)2、MgCO3]等;4×10-8;
=4×10-8 mol·L-1。答案为:MgO[或Mg(OH)2、MgCO3]等;4×10-8;
②常温下,利用Ksp[Mg(OH)2]=1.8×10-11,要使0.01 mol·L-1 MgCl2溶液有沉淀生成,设加入等体积NaOH溶液的浓度为x,则![]() ,x=1.2×10-4 mol·L-1。答案为:1.2×10-4。
,x=1.2×10-4 mol·L-1。答案为:1.2×10-4。


科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116 g跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4 mol
C.参加反应的HCl的质量为146 g
D.被还原的MnO2的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是( )

A.若a的相对分子质量是42,则d是乙醛
B.若d的相对分子质量是44,则a是乙炔
C.若a为苯乙烯(C6H5—CH=CH2),则f的分子式是C16H32O2
D.若a为单烯烃,则d与f的最简式一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是( )
A.装置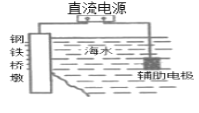 中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
B.装置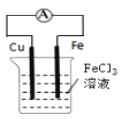 的总反应式:Cu+2Fe3+=Cu2++2Fe2+
的总反应式:Cu+2Fe3+=Cu2++2Fe2+
C.装置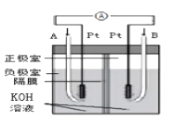 为氢氧燃料电池的工作原理,A中通入的气体是氧气
为氢氧燃料电池的工作原理,A中通入的气体是氧气
D.装置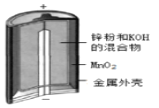 为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
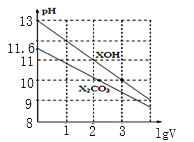
A.XOH是弱碱
B.pH=10的溶液中c(X+):XOH大于X2CO3
C.CO32-的水解常数Kh1约为1.0×10-3.8
D.当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
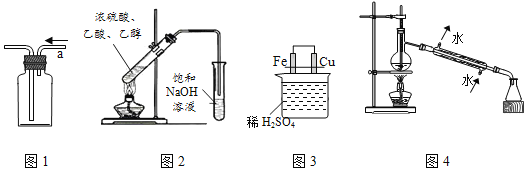
A. 用图1从a口进气可收集乙烯 B. 用图2制取并收集乙酸乙酯
C. 用图3比较Fe、Cu的金属活动性 D. 用图4进行石油的蒸馏实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机化合物相关的说法正确的是![]()
![]()
A.糖类、油脂、蛋白质都能水解,但水解产物不同
B.四苯基乙烯![]()
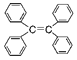
![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.![]() 在一定条件下与足量H2反应消耗4mol H2
在一定条件下与足量H2反应消耗4mol H2
D.分子式为C7H8的芳香烃与H2完全加成所得产物的一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将符合反应类型的反应的序号填在下列分类方法后的横线上
A.4Fe3O4+O2![]() 6Fe2O3
6Fe2O3
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑
D.CaCO3+2HCl=CaCl2+H2O +CO2↑
E.CH4+2O2![]() CO2+2H2O
CO2+2H2O
F. 3O2![]() 2O3
2O3
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.H2SO4+2NaOH=Na2SO4+2H2O
①属于化合反应的是____(填字母,下同)
②属于分解反应的是____;
③属于复分解反应的是____;
④属于置换反应的是____;
⑤既不属于四种基本反应类型又不属于氧化还原反应的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+转化为Fe3+,下列物质可作氧化剂的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就被认定为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com