
【题目】在一真空密闭容器中盛有1 mol PCl5,加热到200 ℃,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2 mol PCl5,反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确是( )
A.m>nB.m<nC.m=nD.无法比较
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
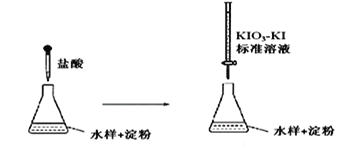
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
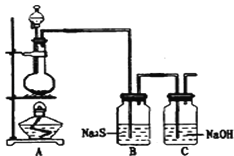
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以明矾![]() 为原料制备Al、
为原料制备Al、![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
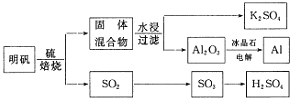
依据上述流程图回答下列问题:
![]() 写出明矾和硫单质混合焙烧发生反应的化学方程式______.
写出明矾和硫单质混合焙烧发生反应的化学方程式______.
![]() 从水浸后的滤液中得到
从水浸后的滤液中得到![]() 晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
晶体的方法是蒸发浓缩、______、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______.
![]() 电解
电解![]() 时加入冰晶石的作用是______.
时加入冰晶石的作用是______.
![]() 以Al和
以Al和![]() 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时![]() 转化为
转化为![]() ,该电池反应的化学方程式是______.
,该电池反应的化学方程式是______.
![]() 焙烧产生的
焙烧产生的![]() 可用于制硫酸.已知
可用于制硫酸.已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
则![]() 和
和![]() 反应的热化学方程式是______.
反应的热化学方程式是______.
![]() 焙烧948吨明矾
焙烧948吨明矾![]() ,若
,若![]() 的利用率为
的利用率为![]() ,则可生产多少吨质量分数为
,则可生产多少吨质量分数为![]() 的硫酸?
的硫酸?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
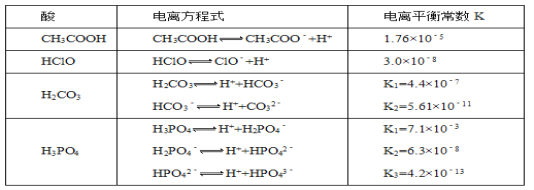
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___________(填化学式,下同),最弱的是_________________
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__________________________,1.2molL﹣1的NaClO溶液pH=__________________________(已知:lg2=0.3)。
(3)求出该温度下,0.10molL﹣1的CH3COOH溶液中的c(H+)=____________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]() B.c(H+)·c(OH-)
B.c(H+)·c(OH-)
C.![]() D.c(OH-)
D.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
(1)该反应的平衡常数K=__。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)__。
(2)根据如图可得出n(CO2)消耗__n(CH4)消耗(填“>”、“<”和“=”,原因是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:

(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为____________CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________(用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。

请根据图示回答下列问题:
(1)图中a电极是______(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为_________________________________________。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为____________________________。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是__。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com