
【题目】有关下列说法正确的是
A.6.8g熔融KHSO4与3.9g Na2O2阴离子数目相同
B.某金属阳离子的结构为![]() 与Cl-形成的强电解质都是离子化合物
与Cl-形成的强电解质都是离子化合物
C.二硫化碳是直线型的非极性分子,其电子式是![]()
D.因为氯、溴、碘非金属性逐渐减弱,所以其氢化物酸性HCl>HBr>HI
【答案】A
【解析】
A.熔融KHSO4与Na2O2化学式中都只含一个阴离子,熔融硫酸氢钾的物质的量=![]() =0.05mol、过氧化钠的物质的量=
=0.05mol、过氧化钠的物质的量=![]() =0.05mol,根据N=nNA知,阴离子个数与其物质的量成正比,物质的量相等,所以阴离子个数相等,故A正确;
=0.05mol,根据N=nNA知,阴离子个数与其物质的量成正比,物质的量相等,所以阴离子个数相等,故A正确;
B.某金属阳离子的结构为:![]() 与Cl-形成的强电解质不一定都是离子化合物,可能是共价化合物,如AlCl3是共价化合物,故B错误;
与Cl-形成的强电解质不一定都是离子化合物,可能是共价化合物,如AlCl3是共价化合物,故B错误;
C.二硫化碳分子中碳原子和每个S原子共用两对电子对,其电子式为![]() ,为直线型分子,故C错误;
,为直线型分子,故C错误;
D.元素的非金属性与其气态氢化物的酸性没有必然关系,氯、溴、碘非金属性逐渐减弱,其氢化物酸性HCl<HBr<HI,故D错误;
故答案为A。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
A. 右图表示反应①中的能量变化

B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.在船舶的外壳装上锌块可防止其发生电化学腐蚀,叫作外加电流的阴极保护法.
B.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
C.FeCl3溶液加热蒸干、灼烧得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以 H3AsO3 形式存在)含量极高,为控制砷的排放, 某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多 2 个电子层,砷在元素周期表的位置为_____。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反 应的离子方程式为_____。
(2)电镀厂的废水中含有的 CN-有剧毒,需要处理加以排放。处理含 CN-废水的方法之一是在 微生物的作用下,CN-被氧气氧化成 HCO3- ,同时生成 NH3,该反应的离子方程式为_____。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子, A―表示乳酸根离子):
①阳极的电极反应式为_____
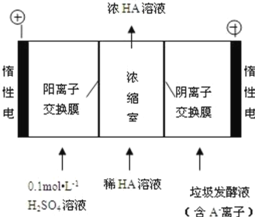
②电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的 OH-可忽略不 计。400 mL 10 g·L-1 乳酸溶液通电一段时间后, 浓度上升为 145 g/L(溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____L (已知:乳酸的摩尔质量为 90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
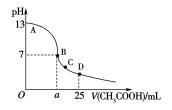
A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年2月,日本产业技术综合研究所能源技术研究部门能源界面技术研究小组组长周豪慎和日本学术振兴会(JSPS)外籍特别研究员王永刚共同开发出了新构造的大容量锂空气电池。下列说法不正确的是

A.放电时的正极反应为O2+2H2O+4e-→4OH-
B.充电时正极附近pH降低
C.若用该电池作电源电解硫酸镁溶液,当电路中有0.02mol e-转移时,阴极增重0.24g
D.在该电池中,放电反应生成的不是固体的Li2O,而是容易溶解在水性电解液中的LiOH(氢氧化锂)。因此,氧化锂在空气电极堆积后,不会导致工作停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料:“氯气与硫在加热条件下生成二氯化硫(S2Cl2),该物质遇水迅速反应,他们利用如下仪器和药品制取纯净的氯气与硫反应来制备S2Cl2
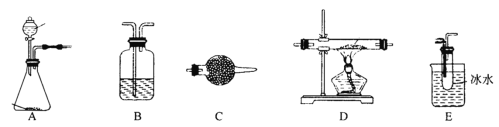
实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:________________
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是____________,第二次装置B的作用是____________________________________________________。
(3)能否省略装置C________(填“能”或“否”),原因是_________________________________。
(4)实验开始后,当_______________________________________________,(填现象)点燃D处的酒精灯。
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确

A. 放电时K+移向负极
B. 放电时电池负极的电极反应为H2-2e-===2H+
C. 放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
D. 该电池充电时将碳电极与电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com