
| V |
| Vm |
| 28L |
| 22.4L/mol |
| 33.6L |
| 22.4L/mol |
| 27g |
| 18g/mol |
| 34g-3mol×1g/mol-1.25mol×12g/mol |
| 16g/mol |


科目:高中化学 来源: 题型:
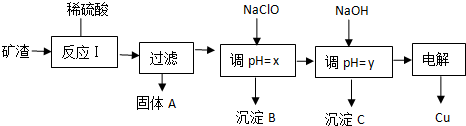
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
科目:高中化学 来源: 题型:
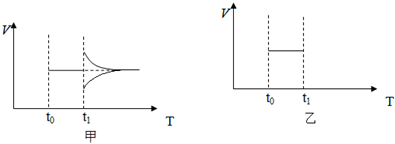
查看答案和解析>>
科目:高中化学 来源: 题型:
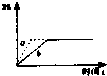 已知反应3A(g)+B(g)?C(s)+4D(g)(正反应放热),如图中a,b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是:
已知反应3A(g)+B(g)?C(s)+4D(g)(正反应放热),如图中a,b表示一定条件下,D的体积分数随时间t的变化情况.若要使曲线b变为曲线a,可采取的措施是:| A、①② | B、①③ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | 浓缩橙汁 |
| 配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、苯甲酸钠等 |
| 鲜橙原汁含量 | ≥20% |
| 净含量 | 1.5L |
| 生产日期 | 标于瓶盖上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯是纯净物 |
| B、光照条件下,2,2二甲基丙烷与Br2反应,其一溴代物只有一种 |
| C、苯酚俗称石炭酸,其水溶液呈弱酸性 |
| D、1溴丙烷和2溴丙烷分别与NaOH的乙醇溶液共热,所得产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com