
����Ŀ����3�ֲ�ͬ�����£��ֱ����ݻ�Ϊ2L�ĺ����ܱ������г���2molA��1molB��������Ӧ��![]()
![]() ��������������ݼ��±���
��������������ݼ��±���
ʵ���� | ʵ��� | ʵ��� | ʵ��� |
��Ӧ�¶�/�� | 700 | 700 | 750 |
��ƽ��ʱ��/min | 40 | 5 | 30 |
n(D)ƽ��/mol | 1.5 | 1.5 | 1 |
��ѧƽ�ⳣ�� | K1 | K2 | K3 |
����˵����ȷ���ǣ� ��
A. ʵ����ƽ�����������������ͨ��1molA��1molD��ƽ�ⲻ�ƶ�
B. �����¶��ܼӿ췴Ӧ���ʵ�ԭ���ǽ����˻�ܣ�ʹ����Ӱٷ������
C. ʵ����ƽ��������ڵ�ѹǿ��ʵ����0.9��
D. K3>K2>K1
���𰸡�A
��������
A���ݻ�Ϊ2L�ĺ����ܱ������г���2molA��1mol B��������Ӧ��2A(g)+B(g)2D(g)��ʵ��III�У�ƽ��ʱn(D)=1mol����n(A)=1mol��n(B)=0.5mol�����c(D)=0.5mol/L��c(A)=0.5mol/L��c(B)=0.25mol/L��750����ƽ�ⳣ��K=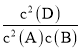 =
=![]() =4���¶Ȳ��䣬��ƽ�ⳣ�����䣬ʵ������ƽ�����������������ͨ��1 mol A��1 mol D�����ʱ������c(A)=1mol/L��c(B)=0.25mol/L��c(D)=1mol/L����ʱŨ����QC=
=4���¶Ȳ��䣬��ƽ�ⳣ�����䣬ʵ������ƽ�����������������ͨ��1 mol A��1 mol D�����ʱ������c(A)=1mol/L��c(B)=0.25mol/L��c(D)=1mol/L����ʱŨ����QC=![]() =4=K����ƽ�ⲻ�����ƶ�����A��ȷ��
=4=K����ƽ�ⲻ�����ƶ�����A��ȷ��
B�������¶Ȳ��ܽ��ͷ�Ӧ�Ļ�ܣ�����ʹ���ַǻ����������������Ϊ����ӣ��������˻���Ӱٷ������������ӵ���Ч��ײ���ᣬ��ѧ��Ӧ���ʼӿ죬��B����
C��������������״̬����PV=nRT��֪������ͬ����������У�PIII��PI=nIIITIII:nITI����Ӧ��ʼʱ�������г���2mol A��1mol B��ʵ��III��ƽ��ʱ��n(D)=1mol�����ݷ�Ӧ����ʽ����ƽ��ʱn(A)=1mol��n(B)=0.5mol��ʵ��I��ƽ��ʱ��n(D)=1.5mol�����ݷ�Ӧ����ʽ��n(A)=0.5mol��n(B)=0.25mol����ʵ��III��ƽ��������ڵ�ѹǿ��ʵ��I��ƽ��������ڵ�ѹǿ֮��=![]() ��0.9����C����
��0.9����C����
D����ӦΪ2A(g)+B(g)2D(g)���Ƚ�ʵ��I��III���¶����ߣ�ƽ��ʱD�������٣���ѧƽ�����淴Ӧ�����ƶ�����K3��K1���¶���ͬ��ƽ�ⳣ����ͬ����K1=K2�����ϣ���ƽ�ⳣ���Ĺ�ϵΪ��K3��K2=K1����D����
��ѡA��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C�������������ģ������ͼ��
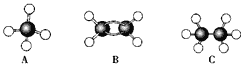
��1��������������������ȫȼ��ʱ��ȥO2����������________(���Ӧ��ĸ����ͬ)��
��2��ͬ״����ͬ�������������������ȫȼ��ʱ��ȥO2����������____________��
��3����������������������ȼ��ʱ�����ɶ�����̼������________������ˮ������________��
��4����120����1.01��105 Pa��ʱ����������̬����������������ϵ�ȼ����ͬ�����²�÷�Ӧǰ���������û�з����仯��������������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ӧ��a��NaOH��HCl��NaCl��H2O b��Cu��2Ag+ ��Cu2+ +2Ag
��1����Ӧ____������ĸ��������Ƴ�ԭ��ء�ԭ����__________________________��
��2��a��ӦΪ______��Ӧ������ȡ������ȡ�����NaOH��HCl��������________������ڡ���С�ڡ����ڡ���NaCl��H2O����������
��3����֪HCl��H-Cl���ļ���Ϊ431 kJ��mol��1����Ͽ�1molH-Cl��_____431 kJ���������γ�1molH-Cl��_____431 kJ��������������ա��ų�����
��4����Ӧ____������ĸ������Ƴ�ԭ��أ��뻭��ʵ��װ��ͼ��ע���缫���Ϻ͵������Һ��__________

д���缫��Ӧʽ����Ӧ����
������Ӧʽ��_____________________��
��Ӧ���ͣ�_______________________��
������Ӧʽ��_____________________��
��5�����������ԭ����У��������ƶ�������Ϊ_______,��ع���һ��ʱ��������Һ��������7.6g���������ص�����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10 L���ܱ������У�1 mol X��1 mol Y���з�Ӧ��2X(g)��Y(g)![]() Z(g) ��H��0����Ӧ��60s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����
Z(g) ��H��0����Ӧ��60s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����
A. ��YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0005 mol/(L��s)
B. �����������䣬���������������20 L����Z��ƽ��Ũ�ȱ�Ϊԭ����1/2
C. �����������䣬�����������С��5L��ƽ�������ƶ���ƽ�ⳣ������
D. �����������䣬�����¶��淴Ӧ���ʼӿ죬����Ӧ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ�Ӧ�㷺���ڻ�ѧ�о�����ҵ������ʳƷ���顢���������ȷ��档
(1)��0.01mol��L-1 Ba(OH)2��Һ��������μ���0.01mol��L-1 H2SO4��Һֱ�����������������л����Һ�ĵ�������(��I��ʾ)�ɽ��Ƶ�����ͼ�е�____________(����ĸ)���߱�ʾ��������Ӧ�����ӷ���ʽΪ__________________________________��

(2)�ᴿ��Ĵ����У�������MgCl2��Na2SO4��CaCl2�ȿ��������ʣ���ͨ���������̵õ��ϴ�����NaCl���塣

������a������d���õ������������÷ֱ���____________��____________��
����������________���ѧʽ�����������Z��Һ��Ŀ����________________��
������e��������____________________��
�������Ƶõ�NaCl�������Ƿ���Na2SO4�ķ�����__________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2��g����O2��g����Ӧ����NO��g�������е������仯��
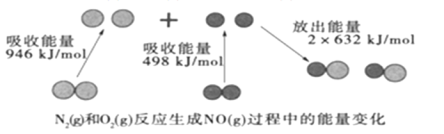
����˵������ȷ���ǣ� ��
A.1molN2��g����1molO2��g����ȫ��Ӧ�ų�������Ϊ180kJ
B.ͨ������£�N2��g����O2��g�������ֱ������NO
C.1molN2��g����1molO2��g�������������2molNO��g�����������
D.NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W ����ͼ��ʾ��ת����ϵ���� X��W���ܵ������()
![]()
��C��O2��Na��O2��Fe��HNO3��S��O2��N2��O2��H2S��O2��NH3��O2
A.����B.����C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298 Kʱ��N2��H2��Ӧ�����������仯������ͼ������������ȷ����

A. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H��-92 kJ��mol
2NH3 ��H��-92 kJ��mol
B. a�����Ǽ������ʱ�������仯����
C. ����������û�ѧ��Ӧ�ķ�Ӧ�Ȳ��ı�
D. ���¶ȡ����һ���������£�ͨ��1 mol N2��3 mol H2��Ӧ��ų�������Ϊ92kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�дٽ���ˮ�ĵ������( )
A. NaHSO4 B. HClO C. Na2SO4 D. CuSO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com