
【题目】乙烯是重要的工业原料,下列有关乙烯的叙述不正确的是( )
A.可与水发生加成反应
B.能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.在一定条件下能够发生加聚反应生成聚乙烯
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述不正确的是
A. 元素种类最多的族是第ⅢB族B. 第ⅠA族元素单质均能与水反应
C. 第ⅡA族中无非金属元素D. 元素周期表中金属元素的种类比非金属元素多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应C(s)+O2(g) =CO2(g)来说,下列有关说法不正确的是( )
A. 增加木炭的物质的量,化学反应速率会加快
B. 升高温度,化学反应速率会加快
C. 将反应容器的体积缩小,化学反应速率会加快
D. 将木炭粉碎成粉末状,化学反应速率会加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
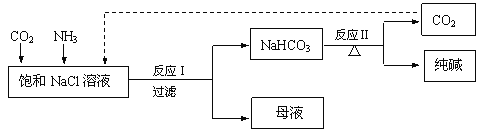
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I CO(g)+2H2(g)![]() CH3 OH(g) △H1
CH3 OH(g) △H1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
Ⅲ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g)![]() CH2OCH3(g)+CO2(g) △H=___________(用△H1、△H2、△H3表示)。
CH2OCH3(g)+CO2(g) △H=___________(用△H1、△H2、△H3表示)。
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H测得CH3OH的浓度与温度关系如图所示:
CH3OCH3(g)+H2O(g) △H测得CH3OH的浓度与温度关系如图所示:

①T1___________T2;△H___________0(填“>”“<”或“=”)。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________(填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示为:2H2(g)+CO(g)![]() CH3OH(g) △H=-91.0kJ·mol-1。向1L的恒容密闭容器中加入0.1molH2和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ
CH3OH(g) △H=-91.0kJ·mol-1。向1L的恒容密闭容器中加入0.1molH2和0.05 mol CO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ
①从反应开始恰好到平衡状态,H2的平均反应速率v(H2)=______________________。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,CH3OH的正反应速率___________CH3OH的逆反应速率(填“大于”“小于”或“等于”)。
(4)氨气是重要化工原料,也可以作能源。常温下,将c1mol·L-1氨水和c2mol·L-1盐酸等体积混合,得到溶液中c(NH4+)=c(Cl-)。在该溶液中离子浓度大小排序为___________。常温下,NH3·H2O的电离常数Kb=___________(用含c1、c2字母的式子表示)
(5)肼(N2H4)一空气燃料电池中氧化产物对环境友好。装置如图所示。

已知:电流由Y极经外电路流向X极,下列有关说法正确的是___________(填代号)
A.放电过程中,OH-向Ⅹ极迁移
B.放电过程中,Y极区电解质溶液的pH减小
C.X极的电极反应式为N2H4-4e-=N2↑+4H+
D.电路上转移2mol电子时至少消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是

A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合后,C装置可作为电镀池装置
C. 当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com