
【题目】2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图。不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键。下列有关M的推断正确的是( )
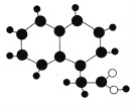
A. M的分子式为C12H12O2
B. M与足量氢气在一定条件下反应的产物的环上一氯代物有7种
C. M能发生中和反应、取代反应
D. 一个M分子最多有11个原子共面
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二环[1,0,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 生成1molC4H10需要2molH2
C. 该化合物与1,3-丁二烯互为同分异构体
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为_____________。
(3) NH4H2PO4中P的_______杂化轨道与O的2p轨道形成 σ 键。
(4)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
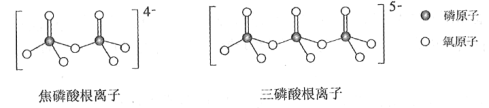
这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2
NaNO3(s)+ClNO(g) ΔH2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3
2ClNO(g) ΔH3
则ΔH1、ΔH2、ΔH3之间的关系为ΔH3=____________。
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能/kJ mol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)反应的ΔH=_________kJ ·mol-1
2ClNO(g)反应的ΔH=_________kJ ·mol-1
(3)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(4)在2 L的恒容密闭容器中充入4mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图。
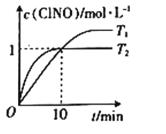
①由图可知T1、T2温度的速率υ1______υ2温度T1______T2。(填>、<或=)
②温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变 d.υ(ClNO)=υ(NO) e.NO与ClNO的物质的量比值保持不变
③反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1D.c(Y2)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
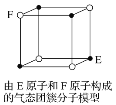
【题目】下列说法中错误的是
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1 mol金刚石晶体中,平均含有2 mol C—C键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲选用下列装置和药品制取纯净乙炔并进行乙炔性质的探究,试回答下列问题:
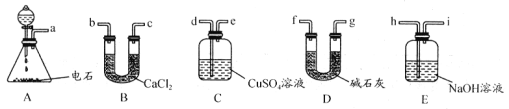
(1)A中制取乙炔的化学反应方程式为_________
(2)制乙炔时,旋开分液漏斗的活塞,使饱和食盐水缓慢滴下的原因是_______
(3)用电石制的乙炔中常含有 H2S、PH3 等杂质,除去杂质应选用____ (填序号,下同) 装置,气体应从____进;C 中通入含杂质的乙炔后有 Cu3P 沉淀、H3PO4 等生成,该反应化学方程式为_____________
(4)一种有机物 Y,与乙炔具有相同的最简式,其相对分子质量是 104。
①若该化合物 Y 分子的一氯代物只有一种且不能使溴水褪色,则 Y 的结构简式为________(用 “键线式”表示)。它的二氯代物有_____种同分异构体。
②前些年,化学家合作合成了一种新型炸药,该炸药分子可以看成是 Y 分子的四硝基(-NO2)取代物,分子结构非常对称,在核磁共振氢谱上观察到氢原子给出的峰只有一个,试画出其结构简式____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com