
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.K37ClO3与浓HCl在加热条件下生成Cl2的化学方程式: K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
B.表示H2燃烧热的热化学方程式: H2(g)+![]() O2(g)=H2O(g)△H= -241.8kJ/mol
O2(g)=H2O(g)△H= -241.8kJ/mol
C.将1~2mLFeCl3饱和溶液滴入到20ml沸水中所发生的离子方程式:Fe3++3H2O ![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
D.在Ba(OH) 2溶液中滴入硫酸氢钠至中性: Ba2++OH-+H++SO42-=BaSO4↓+ H2O
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。
2NH3达到平衡,测得反应放出热量为Q1。
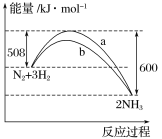
(1)该反应的热化学方程式为__________________________。
(2)Q1________92 kJ(填“>”“<”或“=”)。
(3)曲线a和曲线b中,加了催化剂的是________。
(4)上述反应达到平衡后,升高温度H2的转化率________(填“增大”“不变”或“减小”)。
(5)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为: Q2 ______2Q1(“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.7g的NH+4离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g) + Y(g) ![]() 2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10–5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入
,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入![]() ,反应到某时刻测得各组分的物质的量浓度如下表:
,反应到某时刻测得各组分的物质的量浓度如下表:
物质 |
|
|
|
| 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
A.平衡后升高温度,平衡常数![]()
B.平衡时,![]()
C.平衡时反应混合物的总能量减少20 kJ
D.平衡时再加入与起始等量的![]() ,达到新平衡后
,达到新平衡后![]() 的转化率增大
的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是( )
A.碳酸比苯酚酸性强:2C6H5ONa+CO2+H2O=2C6H5OH+Na2CO3
B.实验室用氯化铝溶液和氨水制备氢氧化铝:Al3++3OH-=Al(OH)3↓
C.工业上用电解法制镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D.向NaOH溶液中通入过量的二氧化硫:SO2+2NaOH=Na2SO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com