
| ||
| ||
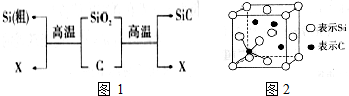
| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| X | ||
| Y | ||
| Z |
| A、X是最活泼的非金属元素 |
| B、Y的最高化合价为+7 |
| C、Z原子的最外层电子数是6 |
| D、3种元素的单质分子都是双原子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
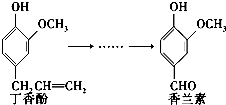 香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )| A、常温下,1 mol丁香酚只能与1 mol Br2反应 |
| B、香兰素分子中至少有12个原子共平面 |
| C、1 mol香兰素最多能与3 mol氢气发生加成反应 |
| D、香兰素和丁香酚都不能与银氨溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
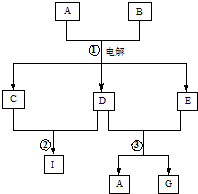 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)| m(Cl2) |
| m(次氯酸盐) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S02气体通入新制氯水中:SO2+2HC1O=2C1-+SO42-+2H+ |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、向NaA102溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓+CO32- |
| D、澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、④⑤⑥⑦ |
| C、①②③⑧ | D、③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
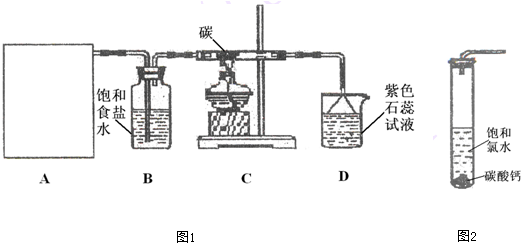
| 实验序号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl晶体、BaC03 |
| B、铁、二氧化硫 |
| C、液态的醋酸、乙醇 |
| D、熔融的K2SO4、盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com