
【题目】下图是有机化学中的几个重要实验。图一是制取乙酸乙酯,图二是验证醋酸、碳酸、苯酚酸性强弱;图三是实验室制取乙炔并检验其部分性质。请根据要求填空。
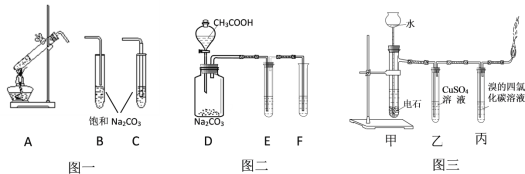
(1)图一中A发生的化学方程式为__________, A的导管应与_______相连(填字母)。
(2)图二中的E和F分别盛装的药品应为_____________和______________。
A.石蕊溶液 B.苯酚钠溶液 C.碳酸氢钠溶液 D.碳酸钠溶液
(3)图三中乙装置的作用是_______________,实验过程中发现燃烧非常剧烈,分析其主要原因是_________________。
【答案】CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O B C B 除去乙炔中H2S和PH3等杂质 直接用水与电石反应,导致生成气体的速度很快
CH3COOCH2CH3+H2O B C B 除去乙炔中H2S和PH3等杂质 直接用水与电石反应,导致生成气体的速度很快
【解析】
(1)图一A中乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水;为了避免发生倒吸现象,吸收乙酸乙酯的导管不能伸入溶液中;
(2)图二是验证醋酸、碳酸、苯酚酸性强弱,醋酸具有挥发性,应该在E中用碳酸氢钠溶液除去挥发出来的醋酸,通过二氧化碳气体与苯酚溶液的反应证明碳酸的酸性大于苯酚;
(3)制取的乙炔中混有的硫化氢、磷化氢等杂质会对乙炔的检验产生干扰,需要用硫酸铜溶液除去;制取乙炔通常用饱和食盐水和电石反应,若用水与电石直接反应会使产生的乙炔的速率较快。
(1)图一中A发生酯化反应,反应的化学方程式为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;吸收乙酸乙酯的导管不能伸入溶液中,否则容易发生倒吸现象,所以A导管应该与B连接;
CH3COOCH2CH3+H2O;吸收乙酸乙酯的导管不能伸入溶液中,否则容易发生倒吸现象,所以A导管应该与B连接;
(2)图二的实验目的是验证醋酸、碳酸、苯酚酸性强弱,通过醋酸与碳酸钠溶液的反应证明醋酸的酸性大于碳酸,通过二氧化碳与苯酚钠的反应证明碳酸的酸性大于苯酚,由于醋酸具有挥发性,D中生成的CO2气体中混有CH3COOH,需要用NaHCO3饱和溶液除去,所以E中试剂是NaHCO3饱和溶液,合理选项是C;F中盛放试剂是苯酚钠溶液,合理选项是B;
(3)电石与水反应生成的乙炔气体中混有H2S和PH3等杂质,H2S和PH3等杂质会影响丙中乙炔性质的检验,需要先用硫酸铜溶液除去;实验室中制取乙炔用饱和食盐水和电石反应,可以减小反应速率,若直接用水与电石反应,会导致反应速率较快。


科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在如图装置中进行实验,向a中加入0.5mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器a的名称是__,仪器b的作用为__。
②能说明甲醛具有还原性的实验现象是__。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物含H2不含CO,将装置A和如图所示的装置连接后进行实验。

①依次连接的合理顺序为A→B→___→____→___→___→G;___
②装置B的作用是___;
③确认气体产物中含H2而不含CO的现象是___。
(3)已知:![]()
![]()
![]()
![]()
![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):

已知:i:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)。
[Cu(NH3)4]2+(蓝色)。
ⅱ:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 溶液中逐滴加入NaOH溶液,所得溶液中
溶液中逐滴加入NaOH溶液,所得溶液中![]() ,
,![]() ,
,![]() 三者物质的量分数
三者物质的量分数![]() 分布系数
分布系数![]() 随PH变化的关系入图1所示。图2为不同浓度
随PH变化的关系入图1所示。图2为不同浓度![]() 溶液中部分微粒浓度。下列表述错误的是
溶液中部分微粒浓度。下列表述错误的是![]()


A.![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液PH恰好为
溶于水中,所得溶液PH恰好为![]()
C.![]() 溶液中一定存在
溶液中一定存在![]() ,同时
,同时![]()
D.在![]()
![]() 溶液中各离子浓度大小关系为:
溶液中各离子浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式如图所示:下列有关说法正确的是( )

A.该有机物的化学式为C11H12OCl2
B.在同一平面上的碳原子数最多为10个
C.与NaOH醇溶液在加热条件下消去氯原子
D.在铜作催化剂和加热条件下能被O2氧化成醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
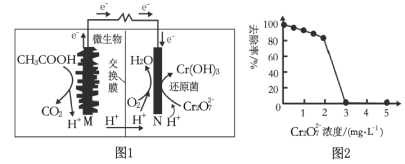
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,发生反应A(g)+B(g)![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
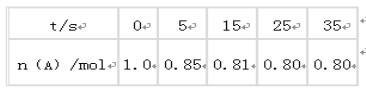
A.反应在前5s的平均速率v(A)= 0. 17mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 molA、0.20 molB和1.0molC,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向25.00mL 0.1 mol·L-1NaOH溶液中滴加0.1 mol·L-1甲酸(HCOOH,弱酸)溶液,所得溶液的pH和pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )
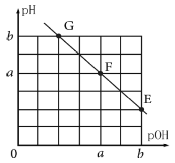
A.F点对应甲酸溶液体积V=25.00 mL
B.F点水的电离程度大于E点水的电离程度
C.温度不变,加水稀释E点溶液,c(HCOOH)/c(HCOO-)增大
D.G点对应溶液c(OH-)=102a-b mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③HCl气体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥B.①②C.②③⑤D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH =7的混合溶液中:![]()
B.pH =2的一元酸和pH =12的一元强碱等体积混合:![]()
C.0.1molL-1的硫酸铵溶液中:![]()
D.0.1molL-1的硫化钠溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com