
【题目】碳酸亚铁可用于制备补血剂。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN-![]() Fe(SCN)64-(无色)
Fe(SCN)64-(无色)
Ⅰ.FeCO3的制取(夹持装置略)
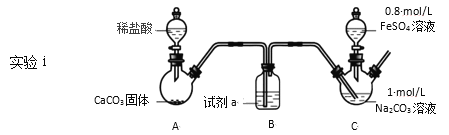
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是__。
(2)向Na2CO3溶液通入CO2的目的是__。
(3)C装置中制取FeCO3的离子方程式为__。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由__。
Ⅱ.FeCO3的性质探究
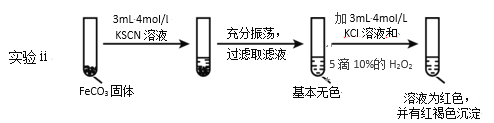
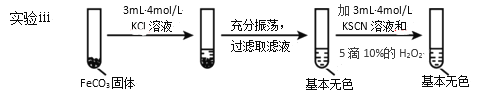
(5)对比实验ⅱ和ⅲ,得出的实验结论是__。
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式__。
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为__。该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是__(不考虑操作不当引起的误差)。
【答案】饱和NaHCO3溶液 降低溶液中OH-浓度,防止生成Fe(OH)2 2HCO3-+Fe2+=FeCO3+CO2↑+H2O 不合理,CO2会和FeCO3反应生成Fe(HCO3)2;合理,排除氧气的影响 Fe2+与SCN—的络合(或结合)会促进FeCO3固体的溶解或FeCO3固体在KSCN溶液中溶解性比KCl溶液中大 6Fe(SCN)64-+3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN-或6Fe2++3H2O2 +12SCN-=2Fe(OH)3↓+4Fe(SCN)3或6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+ FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O 乳酸根中的羟基被KMnO4氧化,也消耗了KMnO4
【解析】
Ⅰ.装置A中碳酸钙和稀盐酸反应生成的CO2中混有挥发的HCl气体,需要利用装置B中盛装的饱和NaHCO3溶液除去,装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体;
Ⅱ.(5)根据Fe2++6SCN-![]() Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
(6)实验ⅱ中溶液显红色且有红褐色沉淀生成,说明加入10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成;
Ⅲ.(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,可结合盐和酸反应生成新酸和新盐的反应原理分析;乳酸根中羟基也能被高锰酸钾溶液氧化。
Ⅰ.(1)欲除去CO2中混有的HCl,则B中盛装的试剂a是饱和NaHCO3溶液;
(2)向Na2CO3溶液通入CO2的目的是,利用碳酸钠和CO2反应生成的NaHCO3,提高溶液中HCO3-的浓度,抑制CO32-的水解,降低溶液中OH-浓度,防止生成Fe(OH)2;
(3)装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,此时溶液中溶质主要为NaHCO3,再滴加FeSO4溶液,有FeCO3沉淀生成,发生反应的离子方程式为2HCO3-+Fe2+=FeCO3+CO2↑+H2O;
(4)FeCO3沉淀能溶解在CO2的水溶液中生成可溶于水的Fe(HCO3)2,降低产物的量,则当出现白色沉淀之后不应继续通CO2;或者:出现白色沉淀之后继续通CO2,可防止空气中氧气氧化FeCO3,提高产物的纯度。
(5)通过对比实验ⅱ和ⅲ,可知Fe2+与SCN—的络合生成可溶于水的Fe(SCN)64-,会促进FeCO3固体的溶解;
(6)依据实验ⅱ的现象,可知在含有Fe2+的溶液中滴加10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成,发生反应的离子方程式为6Fe2++3H2O2 +12SCN-=2Fe(OH)3↓+4Fe(SCN)3;
(7)FeCO3溶于乳酸制得可溶性乳酸亚铁补血剂,发生反应的离子方程式为FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O;乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%。


科目:高中化学 来源: 题型:
【题目】有关如图所示化合物X的说法错误的是
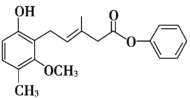
A.X的分子式是C20H20O
B.1 mol该化合物最多可以与3mol NaOH溶液反应
C.X能使酸性高锰酸钾溶液和溴水褪色
D.X在酸性下的两种水解产物都可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,主要反应为![]()
![]()
![]()
已知相关燃烧热数据:
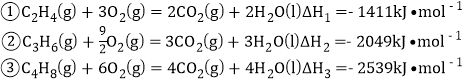
下列说法不正确的是 ( )
A. 消耗等物质的量的原料,反应③的放热最显著
B. 放出相等的热量,反应①产生的![]() 最少
最少
C. “烯烃歧化“反应中消耗![]() ,放热
,放热![]()
D. “烯烃歧化”反应中断键吸收的能量比成键放出的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是首脍炙人口的江苏民歌。乙酸苯甲酯可以从茉莉花中提取,也可用如图路线合成:
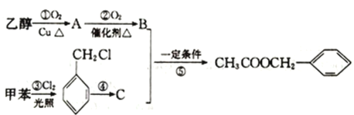
(1)乙酸苯甲酯的分子式为__,C的结构简式为__,B中所含官能团的名称为__,③的反应类型为___。
(2)①的化学方程式为___。
(3)乙酸苯甲酯与NaOH溶液反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:_________、_________、_________。
(2)写出含B元素质量分数最高的化合物的电子式:_____________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:______________________。
(4)用电子式表示化合物C2B的形成过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s)![]() B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 0molL﹣1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( )

A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 molL﹣1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是
A. 对于已达平衡的体系,改变影响化学平衡的条件,不可能出现V正增大,V逆减小的情况。
B. 对2HI![]() H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
C. 升高温度,一定会使化学平衡发生移动。
D. 在盛有一定量NO2的注射器中,向外拉活塞,其中气体颜色先变浅再变深,甚至比原来深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molA与1molB混合于1L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g),2s后A 的转化率为 50%,测得v(D)=0.25 mol/(Ls),下列推断不正确的是
2C(g)+zD(g),2s后A 的转化率为 50%,测得v(D)=0.25 mol/(Ls),下列推断不正确的是
A. z=2 B. 2s时,容器内的压强是初始的7/8倍
C. 2s 时C的体积分数为2/7 D. 2s时,B的浓度为0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com