
【题目】加热熔化氢氧化钠的坩埚,应选用的是( )
A.瓷坩埚B.石英坩埚C.铁坩埚D.铝坩埚
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
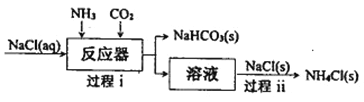
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
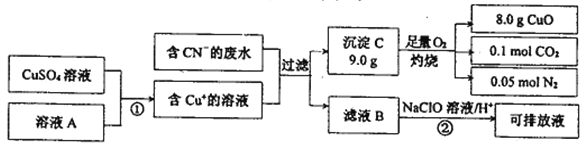
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
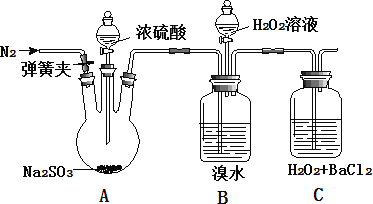
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL。配制过程中可能用到下列仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按使用先后顺序排列正确的是( )
A. ④③⑦⑤⑥ B. ②⑤⑦④⑥ C. ②⑥③⑦⑤⑥ D. ④③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用CuSO4·5H2O晶体配制500 mL 0.1 mol·L-1 CuSO4溶液,回答下列问题:

(1)应该用托盘天平称取CuSO4·5H2O________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.定容前容量瓶底部有水珠__________________________;
B.定容时加水超过刻度线____________________________;
C.最终定容时俯视观察液面__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是:
A. 氢氧化铝与稀硝酸反应:H+ + OH- = H2O
B. MgCl2溶液与氨水反应: Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH![]()
C. CuCl2溶液与铁粉反应: 3Cu2+ + 2Fe =3Cu + 2Fe3+
D. 锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝的碱式碳酸盐是中和胃酸药物的主要成分。欲测定某种镁和铝的碱式碳酸盐的成分进行了以下实验,根据以下实验记录,回答下列问题:
(1)称取6.02g该碱式碳酸盐,加入4.0mol/L盐酸使其溶解,当加入42.5mL时开始产生CO2,当加入盐酸至45.0mL时恰好完全溶解,该碱式碳酸盐中OH-与CO32- 的物质的量之比n(OH-)︰n(CO32-)=__________;
(2)在上述碱式碳酸盐恰好完全溶解所得溶液中加入过量的NaOH溶液,过滤,干燥(不分解)后得3.48g沉淀物。若该碱式碳酸盐中镁元素与氢元素的质量分数之比为6:1,试计算确定该碱式碳酸盐的化学式 __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com