
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是 ( )
| A.高铁电池产生的电流从负极经外电路到达正极 |
| B.正极反应式为Zn+2OH-—2e - =Zn(OH)2 |
| C.负极pH减小,正极pH增大,电解液pH增大 |
| D.每氧化1mol高铁酸钾转移3mol电子 |
科目:高中化学 来源: 题型:计算题
在20mL 0.0025mol·L-1 AgNO3溶液中,加入5mL 0.01mol·L-1 KCl溶液,通过计算判断是否有AgCl沉淀生成。已知Ksp(AgCl)=1.8×10-10 (混合后溶液的总体积为两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 22.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C.电流通过硫酸溶液,SO42- 向正极移动 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各变化中属于原电池的反应的是
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.从海水中通过化学方法得到金属镁 |
| C.红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
| D.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是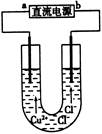
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
| A.H2O (l)+CaO(s) =Ca(OH)2(s) | B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O |
C.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ | D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com