
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若从正反应开始,A、B的初始物质的量之比为1:1,则平衡时A、B的转化率一定相等
【答案】B
【解析】
A. 温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,说明降低压强,平衡向正反应移动,降低压强平衡向气体体积增大的方向移动,故a+b<c+d,A项错误;
B. 若从正反应开始,平衡时A、B的转化率相等,由于转化A、B的物质的量之比等于a:b,所以A、B的初始物质的量之比为a:b,B项正确;
C. 平衡体系中共有气体M mol,再向其中充入b mol B,平衡向正反应移动,达到平衡时气体总物质的量为(M+b) mol,混合气体的总的物质的量不变,故反应前后气体的化学计量数之和相等,即a+b=c+d,C项错误;
D. 若从正反应开始,A、B的初始物质的量之比为1:1,若a:b不是1:1,则转化的A与B物质的量之比不是1:1,平衡时A、B的转化率不相等,D项错误;
答案选B。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
②CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=890.3 kJ·mol1
③CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
④2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1
2H2O(l) ΔH=571.6 kJ·mol1
A. 仅有② B. 仅有②④ C. 仅有②③④ D. 全部符合要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积固定的密闭容器中,发生可逆反应A(s) +3B(g)![]() 3C(g)。下列叙述中能表明该可逆反应一定达到平衡状态的有( )
3C(g)。下列叙述中能表明该可逆反应一定达到平衡状态的有( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总物质的量不再变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
⑦A的浓度不再变化 ⑧混合气体的颜色不再变化
⑨混合气体的平均相对分子质量不再变化
A. 6个B. 5个C. 4个D. 3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。
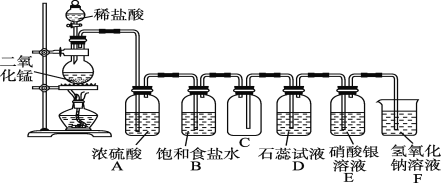
(1)找出在此装置图中出现的错误并加以改正:___。
(2)实验过程中,在D装置中观察到的实验现象是___;在E装置中观察到的实验现象是___,反应的化学方程式是____。
(3)F装置的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
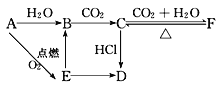
(1)写出A、B、C、D、E、F的化学式:A.__________;B.__________;C.__________;D.__________;E.__________;F.__________。
(2)写出有关反应的离子方程式
B→C:__________________________________。
E→B:___________________________________。
C→F:___________________________________。
(3)写出F→C的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ·mol-1。
(1)写出甲醚燃烧的热化学方程式____;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;计算反应:4C(s)+6H2(g)+O2(g)=2CH3OCH3(g)的反应热为____。
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是____
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1molH2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将___(填“变大”、“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=a kJ·mol-1其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g) ΔH=a kJ·mol-1其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
下列说法中正确的是( )
A.该反应的正反应为放热反应,即a<0
B.当平衡浓度符合c(CO2)·c(H2)=c(CO)·c(H2O)时的温度为830 ℃
C.当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动
D.当v正(H2)=v正(H2O)时该反应达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com