
【题目】如图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。
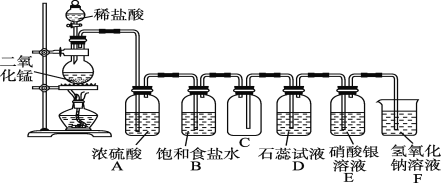
(1)找出在此装置图中出现的错误并加以改正:___。
(2)实验过程中,在D装置中观察到的实验现象是___;在E装置中观察到的实验现象是___,反应的化学方程式是____。
(3)F装置的作用是___。
【答案】稀盐酸改用浓盐酸;B装置应在A装置的左边;C装置中进气管应该长,排气管应该短 溶液先变红后褪色 有白色沉淀生成 Cl2+H2O=HClO+HCl,HCl+AgNO3=AgCl↓+HNO3 吸收多余的氯气,防止污染环境
【解析】
(1)实验室利用MnO2与浓盐酸反应制取氯气,此氯气中常混有盐酸挥发出的HCl和水蒸气;收集氯气时,考虑氯气的密度比空气大,选择进、出气导管的长短。
(2)氯气通入D装置中,先与水反应生成盐酸和次氯酸,盐酸先与石蕊作用,次氯酸后与石蕊作用;在E装置中,氯气与水反应生成的盐酸能与硝酸银作用。
(3)氯气有毒,会造成空气的污染,应进行处理。
(1)稀盐酸与MnO2不反应,所以应将稀盐酸改为浓盐酸;氯气中混入的HCl和水蒸气,应先除HCl,后除水蒸气,所以B装置应在A装置的左边;因为氯气的密度比空气大,导管应左长右短,所以C装置中进气管应该长,排气管应该短。答案为:稀盐酸改用浓盐酸;B装置应在A装置的左边;C装置中进气管应该长,排气管应该短;
(2)氯气通入D装置中,先与水反应生成盐酸和次氯酸,盐酸先与石蕊作用,次氯酸后与石蕊作用,所以在D装置中观察到的实验现象是溶液先变红后褪色;氯气与水反应生成的盐酸能与E装置中的硝酸银作用,所以在E装置中观察到的实验现象是有白色沉淀生成,反应的化学方程式是Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3。答案为:Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3;
(3)氯气有毒,会造成空气的污染,所以使用尾气处理装置,F装置的作用是吸收多余的氯气,防止污染环境。答案为:吸收多余的氯气,防止污染环境。


科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
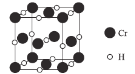
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
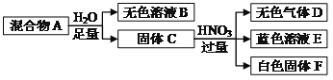
下列推断不正确的是( )
A.无色溶液B做焰色反应实验,火焰可能显紫色
B.白色固体F的主要成分是H2SiO3
C.混合物A中一定含有Na2SiO3、CuSO4和CaCO3
D.在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若从正反应开始,A、B的初始物质的量之比为1:1,则平衡时A、B的转化率一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,不溶于冷水,遇沸水或酸则迅速分解。某化学兴趣小组设计如图实验装置制取铋酸钠。装置丙中盛有Bi(OH)3(难溶于水)与NaOH溶液混合物。下列说法错误的是
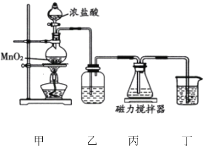
A.装置乙中盛装的试剂是饱和食盐水
B.装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O
C.从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥
D.为除去所得固体中混有的Bi(OH)3,可用稀盐酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。用该装置电解过程中产生的羟基自由基(OH)氧化能力极强,能氧化苯酚为CO2、H2O。下列说法错误的是
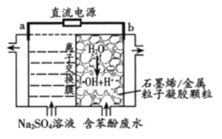
A.阳极电极反应为2H2O—4e-=O2↑+H+
B.H+通过离子交换膜向阴极移动
C.苯酚被氧化的化学方程式为C6H5OH+28OH=6CO2↑+17H2O
D.每转移0.7mole一两极室共产生气体体积为11.2L(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为0;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:A______,B______,C______,D______。
(2)画出下列粒子的结构示意图:A:________________,C2-:__________。
(3)元素A、C、D形成简单离子的半径由大到小的顺序是________________。
(4)写出A、D的最高价氧化物对应水化物反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察如图,然后回答问题。
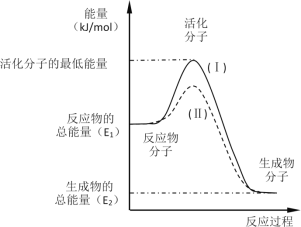
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_________(填“需要”或“不需要”)加热,该反应的△H =___________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g);△H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g)=H2O(g);△H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)已知4克H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:_________
(4)碳燃烧的热化学方程式为: C(s)+O2(g)=CO2(g);△H= -393.5kJ/mol试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com