
【题目】常温下,下列物质可以用铁制容器盛装的是
A. 浓盐酸 B. 浓硫酸 C. 硫酸铜溶液 D. 硝酸银溶液溶液
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题:
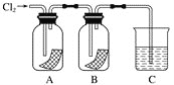
(1)通氯气一段时间后,A中观察到的现象是______________________________,B中观察到的现象是_________________,由此可得出的结论是____________________________,写出有关反应的化学方程式:____________________。
(2)C装置的作用是____________________,理由是_______________________________,写出有关反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应
B. 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C. 物质燃烧都需要氧气
D. 物质燃烧放出热量的多少与外界条件有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分平衡时实验数据见下表(光照、N2压力1.0×105Pa、反应时间1 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的化学方程式:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=a kJ·mol-1
4NH3(g)+3O2(g) ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;(填“>”、“<”或“=”)
(2)从323 K到353 K,氨气的生成量减少的可能原因是_______________________________;(3)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议__________________________________________________。
(4)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:

①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点中H2的转化率最小的是_______点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数为__________________。
N2(g)+3H2(g)的平衡常数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,溶液中能发生如下反应:①2R-+Z2===R2+2Z- ②16H++10Z-+2XO![]() ===2X2++5Z2+8H2O ③2M2++R2===2M3++2R-。由此判断,下列说法中正确的是( )
===2X2++5Z2+8H2O ③2M2++R2===2M3++2R-。由此判断,下列说法中正确的是( )
A. Z2+2M2+===2M3++2Z-不可以进行
B. Z元素在①②反应中都发生还原反应
C. X2+是还原剂XO4—的还原产物
D. 各粒子氧化性由强到弱的顺序是XO![]() >Z2>R2>M3+
>Z2>R2>M3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com