
| 1000ρω |
| M |
| 1000×1.19g/L×36.5% |
| 36.5g/mol |
| 1000ρω |
| M |
| 1000×1.19g/L×36.5% |
| 36.5g/mol |
| 15.8g |
| 158g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ | ||
| B、石灰乳与Na2CO3溶液混合:Ca(OH)2+CO32-=CaCO3↓+2OH- | ||
| C、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ | ||
D、氢氧化钡溶液与稀硫酸反应:Ba2++S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 分子数 | 质量(g) | 物质的量/mol | 摩尔质量(g/mol) |
| O2 | 16 | |||
| H2SO4 | 6.02×1023 | |||
| H2O | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
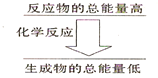 I.写出下列热化学反应方程式
I.写出下列热化学反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因碘酒使蛋白质变性,故常用于外用消毒 |
| B、麻黄碱可用于止咳平喘,就是因为它能起到消炎作用 |
| C、长期大量使用阿司匹林有不良反应,应立即停药并静脉注射Na2CO3溶液 |
| D、能用于治疗胃酸过多的抗酸药有盘尼西林 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com