
【题目】下列对实验方案的设计或评价合理的是( )
A. 经酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示具支试管中,一段时间后导管口有气泡冒出
经酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示具支试管中,一段时间后导管口有气泡冒出
B.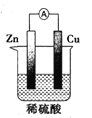 图中电流表会显示电流在较短时间内就会衰减
图中电流表会显示电流在较短时间内就会衰减
C.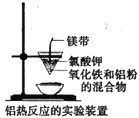 图中应先用燃着的小木条点燃镁带,然后插入混合物中引发反应
图中应先用燃着的小木条点燃镁带,然后插入混合物中引发反应
D.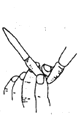 可用图显示的方法除去酸式滴定管尖嘴中的气泡
可用图显示的方法除去酸式滴定管尖嘴中的气泡
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与Al2(SO4)3的物质的量浓度之比为( )
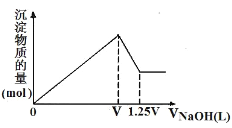
A.1:1B.1:2
C.3:2D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
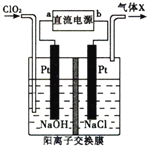
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol/L NaHSO4溶液中,阳离子数目之和为0.2NA
B.标准状况下0.2 mol Cl2溶于水中,转移的电子数为0.2NA
C.常温常压下1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.标准状况下,4.48 L HF含有的分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是_______________________。
(2)铝与氢氧化钾溶液反应的离子方程式是______________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是______________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因______________________。
③除去杂质后的氢氧化钾溶液从液体出口___________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(![]() )为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为
)为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为![]() ;
;![]() ;
;![]() ;
;![]() 。
。
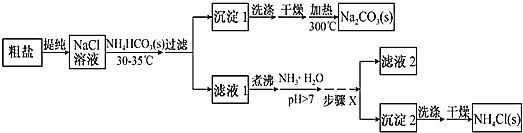
(1)粗盐中主要含有![]() 、
、![]() 、
、![]() 等杂质离子,粗盐提纯时使用的试剂有;①
等杂质离子,粗盐提纯时使用的试剂有;①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
A.①③④② B.①②④③ C.③②④① D.①②③④
(2)如何运用简单的方法判断粗盐中![]() 是否已除尽?__________。
是否已除尽?__________。
(3)从![]() 溶液到沉淀1的过程中,需蒸发浓缩。在加入固体
溶液到沉淀1的过程中,需蒸发浓缩。在加入固体![]() 之前进行蒸发浓缩优于在加入
之前进行蒸发浓缩优于在加入![]() 之后,原因是___________。
之后,原因是___________。
(4)写出沉淀1受热分解的化学方程式:_________。
(5)为提高![]() 产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
(6)某同学拟通过实验来测定该纯碱的纯度(假设杂质只含有![]() ),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的
),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的![]() 溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中
溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中![]() 的质量分数为____________。(用相关字母表示)
的质量分数为____________。(用相关字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物![]() 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的![]() 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和![]() 的阴离子交换柱,使
的阴离子交换柱,使![]() 和
和![]() 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的![]() 用
用![]() 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出![]() 中x的值为_________(取整数)。
中x的值为_________(取整数)。
(2)在实验室中,FeCl2可用铁粉和_________反应制备,FeCl3可用铁粉和_________反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________。(填序号)。
A.若无固体剩余,则溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子
四种离子
B.若溶液中有![]() ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应![]() 发生
发生
D.当溶液中有![]() 存在时,则一定没有
存在时,则一定没有![]() 析出
析出
(4)高铁酸钾(![]() )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在![]() 中铁元素的化合价为_________,
中铁元素的化合价为_________,![]() 与
与![]() 在强碱性条件下反应可制取
在强碱性条件下反应可制取![]() ,其反应的离子方程式为________。
,其反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol·L-1的CH3COOH溶液中,c(H+)=1.0×10-3mol·L-1(忽略水的电离)。
(1)该温度下CH3COOH的电离度__。
(2)CH3COOH的电离平衡常数__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com