
【题目】a g Mg、Al合金完全溶解在c1 mol/L、V1 L HCl溶液中,产生b g H2。再向反应后的溶液中加入c2 mol/L、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是
A. 与金属反应后剩余盐酸中HCl为(c1V1-b) mol
B. c1=![]()
C. 铝失去电子的物质的量为b mol
D. d=a+17b
【答案】C
【解析】
首先发生反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,加入NaOH溶液恰好使沉淀达到最大值,若盐酸剩余,首先发生反应HCl+NaOH═NaCl+H2O(盐酸不剩余,则不发生该反应),然后发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
A、生成bgH2,其物质的量为0.5b mol,根据氢元素守恒,可知消耗盐酸bmol,则剩余HCl为(c1V1-b)mol,选项A正确;
B.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),则C1×V1=C2×V2,故C1=![]() ,选项B正确;
,选项B正确;
C.设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生bg H2, ,解得
,解得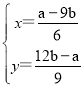 ,铝失去电子的物质的量为
,铝失去电子的物质的量为![]() mol,选项C错误;
mol,选项C错误;
D.根据电子转移守恒可知,金属提供的电子物质的量为![]() ×2=bmol,根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,则d=a+b×17=a+17b,选项D正确;
×2=bmol,根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,则d=a+b×17=a+17b,选项D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
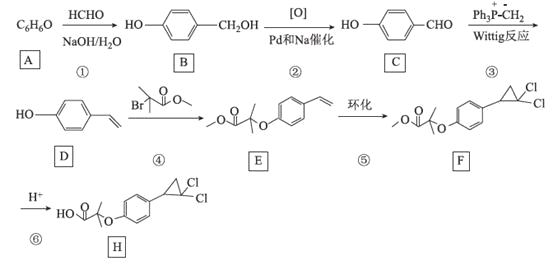
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活有着密切的联系。下列有关说法中错误的是
A.硅是优良的半导体材料,可用于制太阳能电池
B.![]() 俗称磁性氧化铁,常用作红色油漆和涂料
俗称磁性氧化铁,常用作红色油漆和涂料
C.燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
D.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.2000mol/L NH4Cl溶液中逐滴加入0.2000mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是( )

A.a点溶液中:c(H+) + c(NH4+) = c(OH-) + c(NH3·H2O)
B.b点溶液中:c(Cl-) = c(Na+) > c(H+) = c(OH-)
C.c点溶液中:c(NH3·H2O) + c(NH4+) = c(Cl-) + c(OH-)
D.d点溶液中:(Cl-) > c(NH3·H2O) > c(OH-) > c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.装置可用于蒸干AlCl3饱和溶液制备AlCl3晶体
B.装置可测定中和反应反应热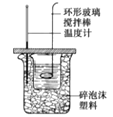
C.图丙装置可以探究温度对Na2S2O3溶液与H2SO4反应的影响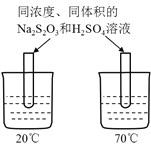
D.图丁装置可以论证醋酸、碳酸、硼酸的酸性强弱顺序为:醋酸>碳酸>硼酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S ![]() HS-+H+和HS-
HS-+H+和HS- ![]() S2-+H+,若向溶液中
S2-+H+,若向溶液中
A.加硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.通入氯气,溶液pH值增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com