
I.(1)向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是_________________。
A.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至显中性
B.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量
Ⅱ.实验室可以用氯酸钾和浓盐酸反应制取氯气,反应式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是____________(填化学式),被还原的元素是____________________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为____________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为_______________(标准状况下)。
Ⅰ、(1) 离子反应中易溶于水的强电解质可以拆开写成离子的形式: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(2) A
Ⅱ、(1)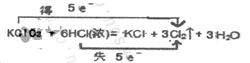
(2) HCl;氯
(3) 1︰5
(4) 13.44L
解析试题分析:Ⅰ、(1) Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(2)B中向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀时,氢氧根离子有剩余,错误;C中向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量时,也是氢氧根离子有剩余,错误;选A。
Ⅱ、(1)略
(2)氧化还原反应中,还原剂,化合价升高,被氧化,发生氧化反应,因此反应中发生氧化反应的物质是HCl;氧化剂,化合价降低,被还原,发生还原反应,因此是氯酸钾中的氯元素被还原。
(3)虽然参加反应的HCl(浓)6mol是,但是参加氧化还原的HCl(浓)只是5mol,因此氧化剂与还原剂的物质的量之比为1︰5。
(4)依(3)的分析可知,被氧化的盐酸为1mol时,生成的气体为0.6mol 转化成标况下的体积就是:13.44L
考点:离子反应以及氧化还原反应的有关知识。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
某强酸性溶液X含有Ba2+、Al3+、N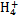 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C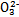 、S
、S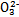 、S
、S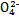 、Cl-、N
、Cl-、N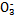 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下: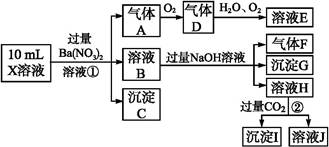
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)="0.04" mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0.3mol电子,则氧化产物的质量是_____g。
(2)将a mol Cl2通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,写出另2个可能发生的离子方程式。
①当 a / b =1时 ;
②当a / b≥3/2时 。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O  Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,试写出其电离方程式: ;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液甲中可能含有下列离子中的几种:K+、NO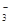 、SO
、SO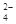 、NH
、NH 、CO
、CO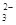 (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为672mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
(1)甲溶液中一定存在的离子是 ;
(2)甲溶液中一定不存在的离子是 ;
(3)甲溶液中可能存在的离子是 ;你得出此结论的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
回答下列问题:
(1)原溶液中一定不存在 。
(2)根据实验和必要的计算确定溶液中一定存在的离子有哪些 (写出必要的推理及计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有以下几种物质 ①碳酸氢钠晶体;②液态氯化氢;③铁;④蔗糖;⑤乙醇;⑥熔融的K2SO4;⑦干冰;⑧石墨;⑨氨气。填空回答:(填序号)
(1)以上物质能导电的是 。
(2)以上物质中属于电解质的是 。
(3)以上物质中属于非电解质的是 。
(4)以上物质中溶于水后水溶液能导电的是 。
(5)分别写出物质①、⑥在水溶液中的电离方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行以下实验:
①取少量白色固体加到足量的水中,得到白色沉淀,上层清液为无色。
②向上述悬浊液中加入足量的稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,白色沉淀不消失。
根据上述实验现象判断:白色固体中一定含有 ,
一定不含有 , 可能会有 ;
上述实验中有关反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: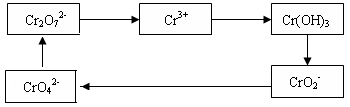
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com