
| A、Al2(SO4)3和氨水 |
| B、Na2CO3和稀盐酸 |
| C、NaCl和AgNO3 |
| D、盐酸和NaAlO2 |


科目:高中化学 来源: 题型:

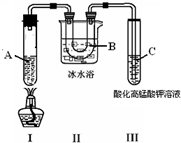
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O即不是氧化产物也不是还原产物 |
| B、N2H4作氧化剂 |
| C、属于置换反应 |
| D、有单质生成的反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
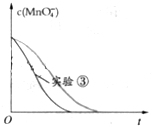 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度 (mol?L-1) | 体积 (mL) | 浓度 (mol?L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶 |
| B、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、蒸馏操作时,冷凝水方向应当由下往上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com