
【题目】常温下,取铝土矿(含有![]() 、FeO、
、FeO、![]() 、
、![]() 等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是
等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是
A. 加入过量NaOH溶液:![]()
B. 加入过量氨水:![]()
C. 通入过量![]() :
:![]()
D. 通入过量![]() :
:![]()
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R 原子序数依次增大。由W、X、Y、R组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润的红色石蕊试纸变蓝的气体。金属单质Z在空气中燃烧生成的化合物可与水发生反应生成气体。下列说法正确的是
A. 简单离子的半径: X < Z < R
B. X的简单氢化物比Y的稳定
C. a、b、c中均含有极性共价健,且 a属于电解质,b和c都属于非电解质
D. W、X、Y、R四种元素形成的化合物一定会促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mLxmol/LCH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如下图所示(忽略温度变化)。下列说法中不正确的是
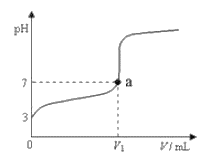
A. 上述CH3COOH溶液中:c(H+)=1×10-3mol/L
B. 图中V1<20mL
C. a点对应的溶液中,c(CH3COO-)=c(Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c(CH3COOH)+c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。下列说法正确的是
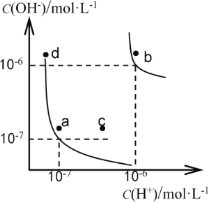
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW数值大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是_________(填编号),其pH值为_______(填数值);pH最大的是________(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:_____________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是____________________,反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族, Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。![]() 原子的最外层电子数是次外层电子数的3倍,试推断:
原子的最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号: X__________、Z__________。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为__________,它的共价键属于__________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为__________;含有极性共价键和非极性共价键的化合物的电子式为_______。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__________;W的单质与水反应时,水作__________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
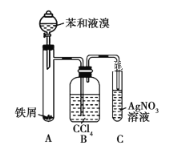
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com