
ΓΨΧβΡΩΓΩΚΘ―σ÷–‘ΧΚ§Ή≈ΖαΗΜΒΡΉ ‘¥ΓΘάϊ”ΟΚΘΥ°Χα»ΓΒ≠Υ°ΓΔδεΚΆΟΨΒΡ≤ΩΖ÷Ιΐ≥Χ»γΆΦΥυ ΨΓΘ
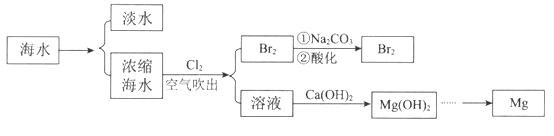
Θ®1Θ©ΚΘΥ°Β≠Μ·ΒΡΖΫΖ®”–_________________ΓΔάκΉ”ΫΜΜΜΖ®ΚΆΒγ…χΈωΖ®Β»ΓΘ
Θ®2Θ©”Ο¥ΩΦνΈϋ ’≈®ΥθΚΘΥ°¥Β≥ωΒΡBr2:
3Br2+ 6Na2CO3+3H2OΘΫ 5NaBr+ NaBrO3+6NaHCO3ΓΘΒ±Έϋ ’3 mol Br2 ±Θ§Ζ¥”Π÷–ΉΣ“ΤΒΡΒγΉ” ΐ «_____________ΓΘ
Θ®3Θ©ΚΘΥ°÷–≤ΩΖ÷άκΉ”ΒΡΚ§ΝΩ»γœ¬ΘΚ
≥…Ζ÷ | Κ§ΝΩΘ® mg/LΘ© | ≥…Ζ÷ | Κ§ΝΩΘ® mg/LΘ© |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
Τδ÷–Θ§Mg2+ΒΡΈο÷ ΒΡΝΩ≈®Ε» «____________ΓΘ»τ“Σ¥”100 LΒΡΚΘΥ°÷–Χα»ΓΟΨΘ§άμ¬έ…œ–η“ΣΦ”»κ≥ΝΒμΦΝCaΘ®OHΘ©2ΒΡ÷ ΝΩ «_______________ΓΘ
Θ®4Θ©”…MgΘ®OHΘ©2÷ΤΒΞ÷ MgΘ§“‘œ¬ΖΫΖ®ΉνΚœ ΒΡ «________________Θ®Χν–ρΚ≈Θ©ΓΘ
AΘ°MgΘ®OHΘ©2 ![]() MgO
MgO![]() Mg
Mg
BΘ°MgΘ®OHΘ©2![]() MgO
MgO![]() Mg
Mg
CΘ°MgΘ®OHΘ©2![]() ΈόΥ°MgCl2
ΈόΥ°MgCl2![]() Mg
Mg
DΘ°MgΘ®OHΘ©2 ![]() MgCl2»ή“Κ
MgCl2»ή“Κ![]() Mg
Mg
ΓΨ¥πΑΗΓΩ’τΝσΖ® 5NA 0.053 mol/LΜρ3.01ΓΝ1024 392.2 g C
ΓΨΫβΈωΓΩ
”…ΧβΗχΝς≥ΧΩ…÷ΣΘ§œρ≈®ΥθΚΘΥ°÷–Ά®»κ¬»ΤχΘ§¬»Τχ”κΚΘΥ°÷–ΒΡδεάκΉ”ΖΔ…ζ÷ΟΜΜΖ¥”Π…ζ≥…ΒΞ÷ δεΘ§”Ο»»Ω’Τχ¥Β≥ωδε’τΤχΘ§δε’τΤχ”κΧΦΥαΡΤ»ή“ΚΖ¥”Π…ζ≥…ΧΦΥα«βΡΤΓΔδεΥαΡΤΚΆδεΜ·ΡΤΘ§ΥαΜ·ΥυΒΟ»ή“ΚΘ§δεΥαΡΤΚΆδεΜ·ΡΤ‘ΎΥα–‘ΧθΦΰœ¬ΖΔ…ζΤγΜ·Ζ¥”Π…ζ≥…ΒΞ÷ δεΘΜœρ Θ”ύ»ή“Κ÷–Φ”»κ«β―θΜ·ΗΤΘ§«β―θΜ·ΗΤ”κ»ή“Κ÷–ΟΨάκΉ”Ζ¥”Π…ζ≥…«β―θΜ·ΟΨ≥ΝΒμΘ§Ιΐ¬ΥΘ§ΫΪ«β―θΜ·ΟΨ»ή”Ύ―ΈΥα÷–ΒΟΒΫ¬»Μ·ΟΨ»ή“ΚΘ§¬»Μ·ΟΨ»ή“Κ‘Ύ¬»Μ·«βΖ’Έß÷–÷Τ»ΓΈόΥ°¬»Μ·ΟΨΘ§ΒγΫβ»έ»Ύ¬»Μ·ΟΨΒΡ÷ΤΒΟΫπ τΟΨΓΘ
Θ®1Θ©ΚΘΥ°Β≠Μ·ΒΡΖΫΖ®÷ς“Σ”–’τΝσΖ®ΓΔάκΉ”ΫΜΜΜΖ®ΓΔΒγ…χΈωΖ®Β»Θ§Ι ¥πΑΗΈΣΘΚ’τΝσΖ®ΘΜ
Θ®2Θ©”…Ζ¥”ΠΖΫ≥Χ ΫΩ…÷ΣΘ§δε’τΤχ”κΧΦΥαΡΤ»ή“ΚΖ¥”Π ±Br‘ΣΥΊΜ·ΚœΦέΖ÷±π”…0Φέ±δΜ·ΈΣ-1ΦέΓΔ+5ΦέΘ§Ζ¥”ΠΉΣ“ΤΒγΉ” ΐΡΩΈΣ5Θ§‘ρ3molδεΒΞ÷ Ζ¥”ΠΒγΉ”ΉΣ“Τ5molΘ§Ι ¥πΑΗΈΣΘΚ5ΘΜ
Θ®3Θ©ΆΦ±μ÷–ΚΘΥ°÷–Mg2+ΒΡΚ§ΝΩ1272mg/LΘ§‘ρΈο÷ ΒΡΝΩ≈®Ε»ΈΣ![]() =0.053mol/LΘ§Φ”»κ«β―θΜ·ΗΤΖΔ…ζ≥ΝΒμΖ¥”ΠΘ§1molMg2+ΒΡ–η“Σ1mol«β―θΜ·ΗΤΆξ»Ϊ≥ΝΒμΘ§100LΚΘΥ°÷–ΟΨάκΉ”ΒΡΈο÷ ΒΡΝΩΈΣnΘ®Mg2+Θ©=0.053mol/LΓΝ100L=5.3molΘ§Φ”»κ≥ΝΒμΦΝCaΘ®OHΘ©2ΒΡ÷ ΝΩ=5.3molΓΝ74g/mol=392.2gΘ§Ι ¥πΑΗΈΣΘΚ0.053ΘΜ392.2ΘΜ
=0.053mol/LΘ§Φ”»κ«β―θΜ·ΗΤΖΔ…ζ≥ΝΒμΖ¥”ΠΘ§1molMg2+ΒΡ–η“Σ1mol«β―θΜ·ΗΤΆξ»Ϊ≥ΝΒμΘ§100LΚΘΥ°÷–ΟΨάκΉ”ΒΡΈο÷ ΒΡΝΩΈΣnΘ®Mg2+Θ©=0.053mol/LΓΝ100L=5.3molΘ§Φ”»κ≥ΝΒμΦΝCaΘ®OHΘ©2ΒΡ÷ ΝΩ=5.3molΓΝ74g/mol=392.2gΘ§Ι ¥πΑΗΈΣΘΚ0.053ΘΜ392.2ΘΜ
Θ®4Θ©AΓΔ―θΜ·ΟΨ»έΒψΗΏΘ§“Σ«σ…η±ΗΧθΦΰΗΏΘ§œϊΚΡΗϋΕύΡή‘¥Θ§≤ΜΨ≠ΦΟΘ§Ι ¥μΈσΘΜ
BΓΔΟΨΡή‘ΎCO2÷–»Φ…’…ζ≥…ΧΦΚΆ―θΜ·ΟΨΘ§ΟΨ «ΜνΤΟΫπ τΘ§Ά®≥Θ”ΟΒγΫβΒΡΖΫΖ®“±ΝΕΘ§≤ΜΡή”ΟΧΦΜΙ‘≠―θΜ·ΟΨ÷Τ±ΗΘ§Ι ¥μΈσΘΜ
CΓΔ«β―θΜ·ΟΨ»ή”Ύ―ΈΥα÷–ΒΟΒΫ¬»Μ·ΟΨ»ή“ΚΘ§¬»Μ·ΟΨ»ή“Κ‘Ύ¬»Μ·«βΖ’Έß÷–÷Τ»ΓΈόΥ°¬»Μ·ΟΨΘ§ΒγΫβ»έ»Ύ¬»Μ·ΟΨΒΡ÷ΤΒΟΫπ τΟΨΘ§Ι ’ΐ»ΖΘΜ
DΓΔΒγΫ⬻̷ΟΨ»ή“ΚΘ§―τΦΪ «¬»άκΉ” ßΒγΉ”…ζ≥…¬»ΤχΘ§“θΦΪ ««βάκΉ”ΒΟΒΫΒγΉ”…ζ≥…«βΤχΘ§»ή“Κ÷–…ζ≥…«β―θΜ·ΟΨ≥ΝΒμΘ§≤ΜΡήΒΟΒΫΫπ τΟΨΘ§Ι D¥μΈσΘΜ
C’ΐ»ΖΘ§Ι ¥πΑΗΈΣΘΚCΓΘ


 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σœ¬Ν–»»Μ·―ßΖΫ≥Χ ΫΘ§”–ΙΊΖ¥”Πλ ±δΒΡ≈–Εœ’ΐ»ΖΒΡ «Θ® Θ©
C(s)ΘΪO2(g)ΘΫCO2(g)ΓΓΠΛH1 CO2(g)ΘΪC(s)ΘΫ2CO(g)ΓΓΠΛH2 2CO(g)ΘΪO2(g)ΘΫ2CO2(g)ΓΓΠΛH3
4Fe(s)ΘΪ3O2(g)ΘΫ2Fe2O3(s)ΓΓΠΛH4 3CO(g)ΘΪFe2O3(s)ΘΫ3CO2(g)ΘΪ2Fe(s)ΓΓΠΛH5
A. ΠΛH1>0Θ§ΠΛH3<0 B. ΠΛH2>0Θ§ΠΛH4>0
C. ΠΛH1ΘΫΠΛH2ΘΪΠΛH3 D. ΠΛH3ΘΫΠΛH4ΘΪΠΛH5
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ![]() ”–œύΆ§»ίΜΐΒΡΕ®»ίΟήΖβ»ίΤςΦΉΚΆ““Θ§ΦΉ÷–Φ”»κ
”–œύΆ§»ίΜΐΒΡΕ®»ίΟήΖβ»ίΤςΦΉΚΆ““Θ§ΦΉ÷–Φ”»κ![]() ΚΆ
ΚΆ![]() Ης0.1mol Θ§““÷–Φ”»κHI 0.2molΘ§œύΆ§Έ¬Ε»œ¬Ζ÷±π¥οΒΫΤΫΚβΓΘ”ϊ ΙΦΉ÷–HIΒΡΤΫΚβ≈®Ε»¥σ”Ύ““÷–HIΒΡΤΫΚβ≈®Ε»Θ§”Π≤…»ΓΒΡ¥κ © «Θ® Θ©
Ης0.1mol Θ§““÷–Φ”»κHI 0.2molΘ§œύΆ§Έ¬Ε»œ¬Ζ÷±π¥οΒΫΤΫΚβΓΘ”ϊ ΙΦΉ÷–HIΒΡΤΫΚβ≈®Ε»¥σ”Ύ““÷–HIΒΡΤΫΚβ≈®Ε»Θ§”Π≤…»ΓΒΡ¥κ © «Θ® Θ©
AΘ°ΦΉΓΔ““ΧαΗΏœύΆ§Έ¬Ε» B. ΦΉ÷–Φ”»κ0.1mol HeΘ§““≤ΜΗΡ±δ
CΘ°ΦΉΫΒΒΆΈ¬Ε»Θ§““≤Μ±δ D. ΦΉ‘ωΦ”0.1mol ![]() Θ§““‘ωΦ”0.1mol I2
Θ§““‘ωΦ”0.1mol I2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Έο÷ ΒΡ”ΟΆΨ÷ς“Σάϊ”ΟΝΥΤδΜ·―ß–‘÷ ΒΡ «Θ® Θ©
ΔΌΨΤΨΪ”ΟΉς»ΦΝœΘΜΔΎΗ…±υ”Ο”Ύ»ΥΙΛΫΒ”ξΘΜΔέO2”Ο”Ύ“ΫΝΤΦ±Ψ»ΘΜΔήœΓ”–ΤχΧεΧν≥δΡόΚγΒΤΓΘ
A.ΔΌΔέΔήB.ΔΌΔέC.ΔέΔήD.ΔΎΔέΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σœ¬Ν–»»Μ·―ßΖΫ≥Χ ΫΘΚ
(1)CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΓςH= - 890.0kJ/mol
(2)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l) ΓςH= - 3119.6kJ/mol
(3)C2H4(g)+3O2(g)==2CO2(g)+2H2O(l) ΓςH= - 1411.0kJ/mol
(4)2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΓςH= - 2599.2kJ/mol
(5)C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) ΓςH= - 2219.9kJ/mol
œ÷”–”……œ ωΈε÷÷Χΰ÷–ΒΡΝΫ÷÷ΉιΚœ≥…ΒΡΜλΚœΤχΧε2molΘ§Ψ≠≥δΖ÷»Φ…’ΚσΖ≈≥ω2970.8kJ»»ΝΩΘ§‘ρœ¬Ν–ΡΡ–©ΉιΚœ «≤ΜΩ…ΡήΒΡ Θ® Θ©
A. CH4ΚΆC3H8 B. C2H4ΚΆC3H8 C. C2H6ΚΆC3H8 D. C2H6ΚΆCH4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩIΓΔœ¬ΆΦ «»ΪΖΑ“ΚΝςΒγ≥ΊΒΡ Ψ“βΆΦ
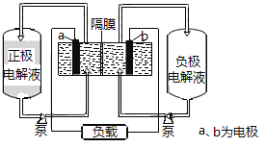
ΗΟΒγ≥Ί≥δΖ≈ΒγΒΡΉήΖ¥”Π ΫΈΣΘΚ![]()
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©≥δΒγ ±ΒΡ“θΦΪΖ¥”Π ΫΈΣ______________Θ§―τΦΪΗΫΫϋ―’…Ϊ±δΜ· «______ΓΘ
Θ®2Θ©Ζ≈ΒγΙΐ≥Χ÷–Θ§’ΐΦΪΗΫΫϋ»ή“ΚΒΡpH ________Θ®―ΓΧνΓΑ…ΐΗΏΓ±ΓΑΫΒΒΆΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
IIΓΔΜΊ ’άϊ”ΟΖœΖΑ¥ΏΜ·ΦΝΘ®÷ς“Σ≥…Ζ÷ΈΣV2O5ΓΔVOSO4ΚΆΕΰ―θΜ·ΙηΘ©ΒΡΙΛ“’Νς≥Χ»γœ¬ΆΦΥυ ΨΓΘ
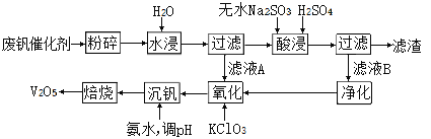
Θ®3Θ©¬Υ‘ϋΩ…”Ο”Ύ______________________Θ®Χν“Μ÷÷”ΟΆΨΘ©ΓΘ
Θ®4Θ©25Γφ ±Θ§»Γ―υΫχ–– Β―ιΖ÷ΈωΘ§ΒΟΒΫΖΑ≥ΝΒμ¬ ΚΆ»ή“ΚpH÷°ΦδΒΡΙΊœΒ»γœ¬±μΥυ ΨΘΚ
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
ΖΑ≥ΝΒμ¬ Θ®ΘΞΘ© | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
ΗυΨί…œ±μ ΐΨί≈–ΕœΘ§Φ”»κΑ±Υ°ΒςΫΎΥαΦν–‘Θ§»ή“ΚΒΡΉνΦ―pHΈΣ____ΘΜ
Θ®5Θ©ΈΣΝΥΧαΗΏΖΑΒΡΫΰ≥ω¬ Θ§”ΟΥαΫΰ ΙΖœΖΑ¥ΏΜ·ΦΝ÷–ΒΡV2O5ΉΣ±δ≥…Ω…»ή”ΎΥ°ΒΡVOSO4Θ§ΥαΫΰΙΐ≥Χ÷–Θ§―θΜ·≤ζΈοΚΆΜΙ‘≠≤ζΈοΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ________ΓΘ
Θ®6Θ©―θΜ·Ιΐ≥Χ÷–Θ§VO2+±δΈΣVO2+Θ§‘ρΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–ΦΉΓΔ““ΓΔ±ϊ»ΐΤΩΒ»ΧεΜΐΓΔΒ»Έο÷ ΒΡΝΩ≈®Ε»ΒΡNaOH»ή“ΚΘ§»τΦΉ≤Μ±δΘ§ΫΪ““’τΖΔΒτ“ΜΑκΥ°Θ®»ή÷ ≤ΜΈω≥ωΘ©Θ§±ϊ÷–Ά®»κ“ΜΕ®ΝΩΒΡCO2 ΓΘ»ΜΚσ“‘ΦΉΜυ≥»Ής÷Η ΨΦΝΘ§”ΟœύΆ§≈®Ε»ΒΡ―ΈΥαΒΈΕ®Θ§Ζ÷±π¥οΒΫ÷’ΒψœϊΚΡ―ΈΥαΒΡΧεΜΐ «
A. VΦΉ=V““ΘΨV±ϊ B. V±ϊΘΨV““ΘΨVΦΉ C. V““ΘΨV±ϊΘΨVΦΉ D. VΦΉ=V““=V±ϊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΡ≥»ίΜΐΙΧΕ®ΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζΩ…ΡφΖ¥”ΠA(s) +3B(g)![]() 3C(g)ΓΘœ¬Ν––π ω÷–Ρή±μΟςΗΟΩ…ΡφΖ¥”Π“ΜΕ®¥οΒΫΤΫΚβΉ¥Χ§ΒΡ”–Θ® Θ©
3C(g)ΓΘœ¬Ν––π ω÷–Ρή±μΟςΗΟΩ…ΡφΖ¥”Π“ΜΕ®¥οΒΫΤΫΚβΉ¥Χ§ΒΡ”–Θ® Θ©
ΔΌCΒΡ…ζ≥…”κΖ÷ΫβΥΌ¬ œύΒ» ΔΎΒΞΈΜ ±ΦδΡΎ…ζ≥…amolAΚΆ3amolB
ΔέBΒΡ≈®Ε»≤Μ‘Ό±δΜ· ΔήΜλΚœΤχΧεΉήΈο÷ ΒΡΝΩ≤Μ‘Ό±δΜ·
ΔίAΓΔBΓΔCΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ3ΘΚ3 ΔόΜλΚœΤχΧεΒΡΟήΕ»≤Μ‘Ό±δΜ·
ΔΏAΒΡ≈®Ε»≤Μ‘Ό±δΜ· ΔύΜλΚœΤχΧεΒΡ―’…Ϊ≤Μ‘Ό±δΜ·
ΔαΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘Ό±δΜ·
A. 6ΗωB. 5ΗωC. 4ΗωD. 3Ηω
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΣΥΊ÷ήΤΎ±μ «―ßœΑΜ·―ßΒΡ÷Ί“ΣΙΛΨΏ,Υϋ“ΰΚ§–μΕύ–≈œΔΚΆΙφ¬…ΓΘœ¬±μΥυΝ– «Νυ÷÷ΕΧ÷ήΤΎ‘ΣΥΊΒΡ‘≠Ή”ΑκΨΕΦΑ÷ς“ΣΜ·ΚœΦέ(“―÷Σνκ‘ΣΥΊΒΡ‘≠Ή”ΑκΨΕΈΣ0.089 nm)ΓΘ
‘ΣΥΊ¥ζΚ≈ | A | B | C | D | X | Y |
‘≠Ή”ΑκΨΕ/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
÷ς“ΣΜ·ΚœΦέ | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
Θ®1Θ©C‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷ΟΈΣ________Θ§ΤδάκΉ”ΫαΙΙ Ψ“βΆΦΈΣΘΚ_______ΓΘ
Θ®2Θ©BΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·Έο”κYΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·ΈοΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___ΓΘ
Θ®3Θ©ΙΊ”ΎCΓΔD ΝΫ÷÷‘ΣΥΊΥΒΖ®’ΐ»ΖΒΡ «__________Θ®Χν–ρΚ≈Θ©ΓΘ
a.ΦρΒΞάκΉ”ΒΡΑκΨΕD>C b.ΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘D±»C«Ω c.ΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·ΈοΒΡΥα–‘C±»D«Ω
Θ®4Θ©‘Ύ100mL18mol/LΒΡCΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·ΈοΒΡ≈®»ή“Κ÷–Φ”»κΙΐΝΩΒΡΆ≠Τ§Θ§Φ”»» ΙΤδ≥δΖ÷Ζ¥”ΠΘ§≤ζ…ζΤχΧεΒΡΧεΜΐΈΣ6.72L(±ξΩωœ¬Θ©Θ§‘ρΗΟΖ¥”ΠΙΐ≥Χ÷–ΉΣ“ΤΒΡΒγΉ” ΐΈΣ______ΓΘ
Θ®5Θ©–¥≥ω”…AΓΔDΓΔX»ΐ÷÷‘ΣΥΊΉι≥…ΒΡΡ≥÷÷Ω…“‘œϊΕΨ…±ΨζΈο÷ ΒΡΒγΉ” Ϋ_____________ΓΘ
Θ®6Θ©±»ΫœY‘ΣΥΊ”κΤδΆ§ΉεΕΧ÷ήΤΎ‘ΣΥΊΒΡ«βΜ·ΈοΒΡ»έΖ–ΒψΗΏΒΆ__ ΘΨ___ (Χν«βΜ·ΈοΜ·―ß ΫΘ©Θ§άμ”…___________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com