
【题目】胶体区别于其它分散系最本质的特征是( )
A.外观透明澄清
B.分散质粒子直径介于1﹣100nm
C.静置,不出现分层
D.有丁达尔现象
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于一个反应可以从多个角度认识。下列关于盐酸与NaOH溶液反应的说法不正确的是
A.属于复分解反应B.属于离子反应
C.属于中和反应D.属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
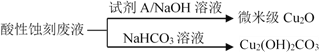
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
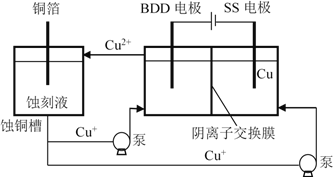
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )

①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→⑧;⑦→⑥;⑤→④;
③C装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.钠和钾的合金可用于快中子反应堆作热交换剂
B.可用超纯硅制造的单晶硅来制造芯片
C.二氧化硅可用于制造玻璃
D.氯气有毒,不能用于药物的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g) ,已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g) ,已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
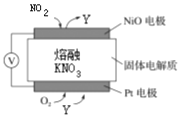
【题目】(1)通过NOx传感器可监测NOx的含量,其工作原理示意图如下图。回答下列问题:
①Pt电极上还需通入的气体是________。
②写出NiO电极的电极反应式:_____________________________________________。
(2)盐桥电池是一种比较普遍的原电池,该电池反应原理如下图所示。
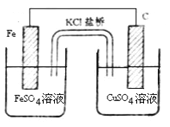
①负极电极反应式为________。
②当电路中通过电子为0.1mol时,两电极质量差为___g,此时原电池电解质溶液的总质量与开始时电解质溶液总质量差值为___g(不考虑溶液离子向盐桥移动)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com