
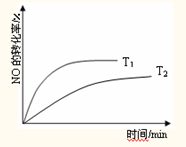
 随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化的排放的控制力度.消除氮氧化物污染有多种方法,其中一种是用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0.
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化的排放的控制力度.消除氮氧化物污染有多种方法,其中一种是用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0.| 时间/min | 0 | 20 | 40 | 50 |
| c(NO)/mol?L-1 | 0.100 | 0.040 | 0.032 | 0.032 |
| c(N2)/mol?L-1 | 0 | 0.030 | 0.034 | 0.034 |
| △c |
| △t |
| (0.1-0.04)mol/L |
| 20min |
| △c |
| △t |
| (0.1-0.04)mol/L |
| 20min |
| c(N2)c(CO2) |
| c2(NO) |
| 0.034×0.034 |
| 0.0322 |
 ;
; .
.


科目:高中化学 来源: 题型:
| A、在含Fe2+的溶液中:Cl-、S2-、K+、I- |
| B、在c(H+)=0.01 mol?L-1的溶液中:Cu2+、Br-、SO42-、NH4+ |
| C、在使甲基橙呈红色的溶液中:Mg2+、Cl-、S2O32-、Na+ |
| D、在无色溶液中:Cr2O72-、K+、H+、CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | H2O2溶液浓度 | 加入的其它物质 |
| ① | 25 | 5% | -- |
| ② | 50 | 10% | -- |
| ③ | 25 | 5% | MnO2 |
| ④ | 50 | 10% | FeCl3 |
| A、实验①和②可探究温度对该反应速率的影响 |
| B、实验①和②可探究H2O2溶液浓度对该反应速率的影响 |
| C、实验①和③可探究催化剂MnO2对该反应速率的影响 |
| D、实验③和④可比较MnO2和FeCl3两种催化剂对该反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的
如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
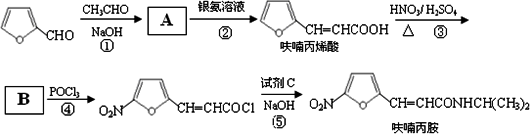
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com