
| m |
| M |
| m |
| M |
| 17g |
| 17g/mol |
| m |
| M |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与14N 含有的中子数相同 |
| B、是C60的同素异形体 |
| C、与C60中普通碳原子的化学性质不同 |
| D、与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是最内层电子数的2倍 |
| C | 阴离子带有两个单位的负电荷,单质是空气的主要成分之一 |
| D | 其阳离子与C的阴离子具有相同的电子层结构,且阳离子半径在同周期中最小 |
| E | 最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1×10-10 mol/L |
| B、1×10-3 mol/L |
| C、1×10-4mol/L |
| D、1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
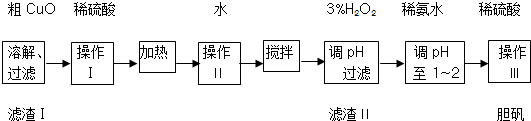
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com