
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是最内层电子数的2倍 |
| C | 阴离子带有两个单位的负电荷,单质是空气的主要成分之一 |
| D | 其阳离子与C的阴离子具有相同的电子层结构,且阳离子半径在同周期中最小 |
| E | 最高正价与最低负价的代数和为4 |
| 10-14 |
| 10-a |
| 10-a |
| 10a-14 |
 ,0.2molCS2在O2中完全燃烧,生成两种气态氧化物:二氧化碳与二氧化硫,298K时放出热量215kJ,故1mol完全反应放出热量为
,0.2molCS2在O2中完全燃烧,生成两种气态氧化物:二氧化碳与二氧化硫,298K时放出热量215kJ,故1mol完全反应放出热量为| 215kJ |
| 0.2mol |
 ;CS2(l)+3 O2(g)=CO2(g)+2SO2(g);△H=-1075 kJ?mol-1.
;CS2(l)+3 O2(g)=CO2(g)+2SO2(g);△H=-1075 kJ?mol-1.


科目:高中化学 来源: 题型:
| A、若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,则H2燃烧热为241.8kJ?mol-1 |
| B、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| C、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| D、由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ?mol-1① BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1②可得反应C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 g金刚石和足球烯(C60)的混合物中含有NA个碳原子 |
| B、2 molCH4的摩尔质量是32 g?mol-1 |
| C、标准状况下2.24 L H2O中含有0.1 NA个氧原子 |
| D、4 g NaOH溶解在100 mL水中配成1 mol?L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
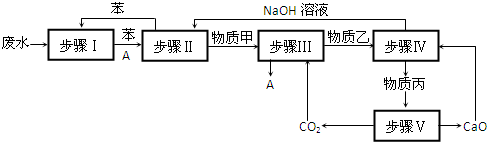
查看答案和解析>>
科目:高中化学 来源: 题型:
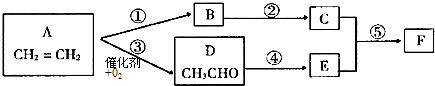
查看答案和解析>>
科目:高中化学 来源: 题型:
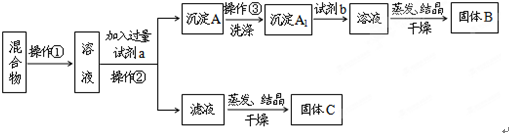
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com