
【题目】二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法不正确的是( )
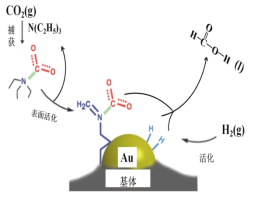
A. 二氧化碳的电子式: ![]()
B. 在捕获过程,二氧化碳分子中的共价键完全断裂
C. N(C2H5)3能够协助二氧化碳到达催化剂表面
D. CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
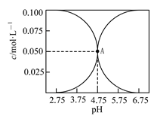
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
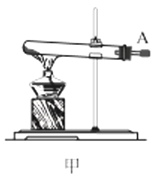
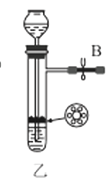

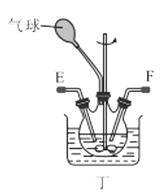
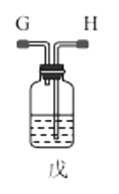
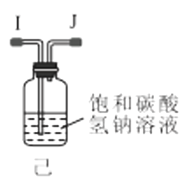
(1)利用装置甲制备氨气的化学方程式为__。
(2)简述检查装置乙气密性的操作__。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__→__→EF←__←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__(填“热水浴”或“冷水浴”);丁中气球的作用是__。
(5)从装置丁的混合物中分离出产品的方法是__(填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__(已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬独液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 AG 表示溶液酸度:AG=lg![]() 。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
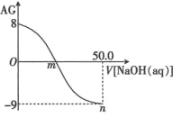
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
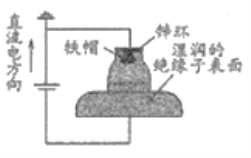
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
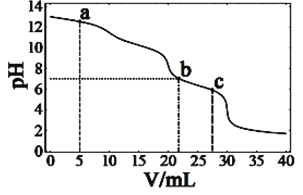
A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com