
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.1 mol NaCl中含有NaCl分子数为NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.1 mol Fe高温条件下与水蒸气反应,电子转移数为3NA
D.12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA
【答案】D
【解析】
A.氯化钠是离子晶体,晶体中不存在氯化钠分子,故A错误;
B.室温下pH=13的NaOH溶液中氢离子浓度为1×10-13mol/L,由于氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,所以由水电离的OH-离子的浓度与溶液中氢离子浓度相同,1 L pH=13的NaOH溶液中,由水电离的OH-数目为1×10-13NA,故B错误;
C.铁和水蒸气的反应方程式为3Fe + 4H2O(g)![]() Fe3O4 + 4H2,反应后铁变为+
Fe3O4 + 4H2,反应后铁变为+![]() 价,故1mol铁转移的电子数为
价,故1mol铁转移的电子数为![]() NA个,故C错误;
NA个,故C错误;
D.12g石墨烯(单层石墨)中碳原子的物质的量为1mol,由于在石墨中一个C原子参与三个环的形成,故1mol六元环中含6mol×![]() =2mol碳原子,则1mol石墨烯中含0.5mol六元环,故含0.5NA个六元环,故D正确;
=2mol碳原子,则1mol石墨烯中含0.5mol六元环,故含0.5NA个六元环,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
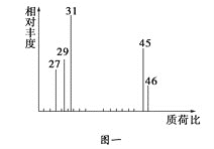
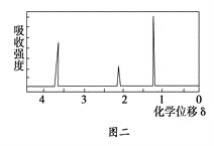
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)很多含氯物质都能做消毒剂。液氯可以用于饮用水消毒,但是消毒后的水中可能产生危害人体健康的有机氧化物。世界各国陆续开发新型自来水消毒剂,下列物质可以用于自来水消毒的有___。
A.Na2O2 B.Cl2O2 C.O3 D.O2 E.ClO2
(2)Na2FeO4为紫色物质,也可以用于自来水消毒,高铁酸钠处理过的水中含有氢氧化铁胶体,用激光笔照射,可以从侧面看到一条光路,这个现象在化学上被成为___。
(3)漂白液是一种常用消毒剂,其中的有效成分是___(写出化学式)。
(4)漂白粉也是常见消毒剂。工业上使用漂白粉一般加入少量盐酸或醋酸,促使___(填写出物质名称)产生,以增强漂白杀菌作用。请用化学方程式表示家用漂白粉不加入酸如何产生该物质___。
(5)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。请配平完成该过程的化学方程式:__Ca(ClO)2+__HCl=__Cl2↑+__CaCl2+__。生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯=(漂白粉加酸所释放出的氯气的质量/漂白粉的质量)×100%。漂白粉的有效氯一般高于30%,某化工厂漂白粉2g进行上述一系列反应进行测定,消耗硫代硫酸钠0.02mol,则其有效氯为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
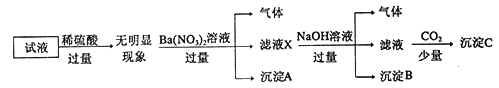
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将一小块金属钠置于表面皿上,并露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白
变白![]() 表面出现液滴
表面出现液滴![]() 白色固体
白色固体![]() 白色粉末,下列说法正确的是( )
白色粉末,下列说法正确的是( )
A.过程①钠转化为过氧化钠
B.过程③是碳酸钠吸收空气中的水蒸气形成溶液
C.过程④只发生了物理变化
D.如果时间足够长,最后得到的白色粉末是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验小组用50mL 1.0mol·L-1的盐酸与50mL 1.1mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少的一种仪器,该仪器名称为_________。
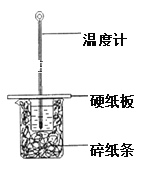
(2)如果改用60mL 1.Omol·L-1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量____________(填“增加” “减少”或“不变”),所求中和热数值 ________ (填“增加”“减少”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com