
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是( )
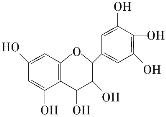
A.该物质可以看作醇类,也可看做酚类
B.1mol该物质可与7molNa2CO3反应
C.该物质遇FeCl3会发生显色反应
D.1mol该物质可与4molBr2反应
科目:高中化学 来源: 题型:
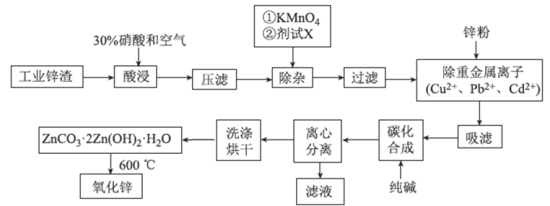
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣![]() 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物,![]() 、
、![]() 、
、![]() 等
等![]() 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示:
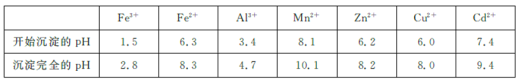
已知:相关金属离子![]() 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
![]() 为调节溶液的pH,则试剂X为_________
为调节溶液的pH,则试剂X为_________![]() 填化学式
填化学式![]() ,
,
![]() 除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
![]() “过滤”所得滤渣的主要成分是_________
“过滤”所得滤渣的主要成分是_________![]() 填化学式
填化学式![]() 。
。
![]() 写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中错误的是
A.溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去
B.除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层
C.除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
D.用![]() 溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛(苯甲醛),下列说法正确的是( )
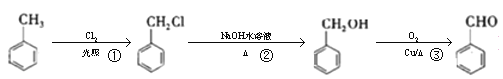
A.![]() 可以作为萃取剂萃取溴水中的溴单质
可以作为萃取剂萃取溴水中的溴单质
B.反应①②③的反应类型相同
C.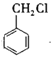 的同分异构体有3种
的同分异构体有3种
D. 和
和![]() 可以通过酸性高锰酸钾鉴别
可以通过酸性高锰酸钾鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
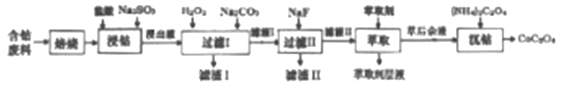
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
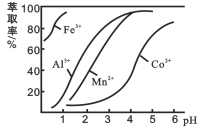
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Mn+(指Cu2+或Ag+)的硫化物的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
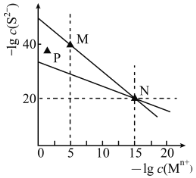
A.直线MN代表CuS的沉淀溶解平衡
B.在N点Ksp(CuS)=Ksp(Ag2S)
C.P点:易析出CuS沉淀,不易析出Ag2S沉淀
D.M点和N点的c(S2-)之比为1×10-20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入1或2滴酚酞溶液
⑤滴入一滴标准液后,溶液颜色由无色变为红色立即停止滴定,记录液面读数
请回答:

(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A 酸式滴定管未润洗
B 滴定前,滴定管尖嘴无气泡,滴定后有气泡
C 锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D 滴定结束时仰视滴定管,并记录数据
E 滴定过程中有一滴标准液飞溅出锥形瓶
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_______________。
II.利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
(5)水泥中钙经处理得草酸钙沉淀经稀H2SO4处理后,用![]() 标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反为:
标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反为:![]() .实验中称取0.400g水泥样品,滴定时消耗了0.0500 mol·L-1的
.实验中称取0.400g水泥样品,滴定时消耗了0.0500 mol·L-1的![]() 溶液36.00 mL,则该水泥样品中钙的质量分数为__________
溶液36.00 mL,则该水泥样品中钙的质量分数为__________
(6)滴定终点的现象是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com