
向某晶体的水溶液加入含Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现红色,那么由此得出的下列结论错误的是( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+与SCN-不能形成红色的化合物
D.Fe2+被Br2氧化成Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.日常生活中无水乙醇常用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
除 去下列括号内杂质的试剂或方法错误的是
去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C .KNO3晶体(NaCl),蒸馏水,结晶
.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
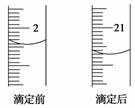
| 滴定次数 | 用去NaOH溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 体积(mL) | |
| 1 | 3.20 | 22.48 | |
| 2 | 1.23 | 20.55 | |
| 3 | — | — |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是________。
A.酸式滴定管 B.烧杯
C.100 mL容量瓶 D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用___________________________________________。
(4)滴定操作时,左手应____________,观察滴定管里液面的高度时应注意________________________________。
(5)选用的合适指示剂是________,变色情况是____________________________________。
(6)计算稀释后容量瓶中醋酸的物质的量浓度________________________________________________。
(7)计算“老谢琼醋”中醋酸的质量分数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组欲探究铁及其化合物的氧化性或还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺的一种玻璃仪器是________。
(2)请帮他们完成以下实验报告:
实验目的:__________________________________________________。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=== Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+===3Fe2+ | Fe3+具有氧化性,Fe具有还原性 | |
| ④ | 溶液 | Fe3+具有氧化性 |
实验结论:
Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有________(填序号)。
A.Cl2 B.HCl C.Na+ D.F- E.SO2 F.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1 mol Ag。则下列结论中不正确的是( )
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1∶2
B.氧化性:Ag+>Fe3+>Cu2+>Zn2+
C.含Fe3+的溶液可腐蚀铜板
D.1 mol Fe可还原3 mol Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com