
【题目】无机化合物可根据其组成和性质进行分类,

(1)如图所示的物质分类方法名称是___。
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑧、⑩后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②__ | ③NaOH ④___ | ⑤Na2SO4 ⑥___ | ⑦SO2 ⑧__ | ⑨NH3 ⑩__ |
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为:___。
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于___盐(填正盐、酸式盐或碱式盐)。
【答案】树状分类法 HNO3(或H2SO3) KOH(或NH3·H2O) K2SO4 SO3 H2S SO2+2NaOH=Na2SO3+H2O 正盐
【解析】
(1)树状分类法中,物质按照层次,一层一层来分,就像一棵大树一样;
(2)H、O、N组成的硝酸或H、O、S组成的亚硫酸属于酸;K、H、O组成的KOH或H、O、N组成的一水合氨属于碱;K、O、N组成的硝酸钾或 Na、O、N组成的硝酸钠等属于盐;K、Na、H、S、N分别与 O可组成氧化物;K、Na、O、S、N分别与 H组成氢化物;
(3)少量的SO2与NaOH反应生成亚硫酸钠和水;
(4)亚磷酸(H3PO3),属于二元弱酸,H3PO3电离时只能产生2个氢离子;
(1)树状分类法中,物质按照层次,一层一层来分,就像一棵大树一样,图示的物质分类为树状分类法;
(2)H、O、N组成的硝酸或H、O、S组成的亚硫酸属于酸;K、H、O组成的KOH或H、O、N组成的一水合氨属于碱;K、O、N组成的硝酸钾或 Na、O、N组成的硝酸钠等属于盐;K、Na、H、S、N分别与 O可组成氧化物;K、Na、O、S、N分别与 H组成氢化物;
(3)少量的SO2与NaOH反应生成亚硫酸钠和水,反应的方程式为SO2+2NaOH=Na2SO3+H2O;
(4)亚磷酸(H3PO3),属于二元弱酸,H3PO3电离时只能产生2个氢离子,则Na2HPO3属于正盐。


科目:高中化学 来源: 题型:
【题目】现有三个反应:
反应① Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H1 平衡常数为K1
FeO(s)+H2(g) △H1 平衡常数为K1
反应② CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2 平衡常数为K2
H2(g)+CO2(g) △H2 平衡常数为K2
反应③ Fe(s)+CO2 (g)![]() FeO(s)+CO(g) △H3 平衡常数为K3
FeO(s)+CO(g) △H3 平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1)K1的表达式为________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______。
(2)要使反应①在一定条件下建立的平衡右移,可采取的措施有_________。(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少FeO的量
(3)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/ mol | 0.60 | 0.20 |
①反应在2 min内的平均速率为v(H2O)=________________;
②800℃时,K2的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率_______________(填“增大”或“减小”或“不变”)。
(4)由以上信息推断反应③正反应方向为________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得两个电子,B元素的原子失去1个电子后所形成微粒均与氩原子有相同的电子层结构。C元素的原子只有1个电子,D元素原子的M电子层数比N层电子数多6个。试写出:
(1)A、B、C、D的元素符号和名称:A____ B____C____D____。
(2)A元素的原子结构示意图____,D元素的离子结构示意图:______。
(3)画出A离子的电子式____B原子的电子式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时n(A)为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成n(C)为________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别是ymol和3amol,则x=________,y=________。平衡时,n(B)________(填序号)。
A.大于2mol B.等于2mol C.小于2mol D.可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
(5)若保持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB,达到平衡后,生成b molC,将b与a进行比较,则________(填序号)。
A.a<b B.a>b C.a=b D.不能比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
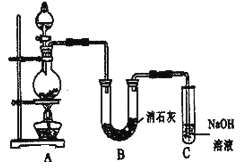
(1)A、B中的反应物分别是浓盐酸和MnO2。写出所发生的化学方程式__________,进入装置C的气体中所含杂质是_____、_____。
(2)漂白粉的有效成分是____(填化学式);D中所发生的化学反应的离子方程式是_______。
(3)此实验所得漂白粉的Ca(ClO)2产率偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是__。②为避免另一副反应的发生,应采取的措施是________。
(4)若将该实验中残留的Cl2,缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:________,若将KI改为KBr溶液,则溶液变为__色,未检测到HBrO3的存在。由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下发生反应:N2(g)+3 H2 (g)![]() 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
A. 原混合气体的体积为1.2V L B. 反应达平衡时N2消耗掉0.2 V L
C. 原混合气体的体积为1.1VL D. 反应达平衡时H2消耗掉0.5 V L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com