
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| n(X) | n(Y) |
查看答案和解析>>
科目: 来源: 题型:
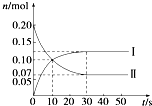 在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.查看答案和解析>>
科目: 来源: 题型:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.查看答案和解析>>
科目: 来源: 题型:
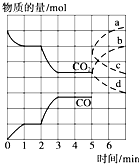 在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g).其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示.
在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g).其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示.查看答案和解析>>
科目: 来源: 题型:
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目: 来源: 题型:
在相同温度下,体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应.平衡时有关数据如下(已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1).
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com