
科目: 来源: 题型:选择题
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )| A. | 电解过程中OH-从a极区通过离子交换膜c进入b极区 | |
| B. | 随着电解进行,KOH溶液浓度会逐渐减小 | |
| C. | 当阳极有0.1mol I-放电时,阴极生成6.72LH2 | |
| D. | a电极反应式:I--6e-+6OH-═IO3-+3H2O,a极区的KI最终转变为KIO3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 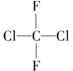 和 和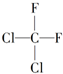 是两种不同的物质 是两种不同的物质 | |
| B. | 聚氯乙烯的单体为CH2═CHCl | |
| C. | 乙烷和乙烯均能使酸性KMnO4溶液褪色 | |
| D. | 1 mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
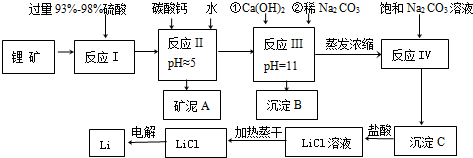
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目: 来源: 题型:选择题
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )| A. | 放电过程中,Li+向正极移动 | |
| B. | 常温下电解质是不导电的固体,电池不工作 | |
| C. | 每转移0.1 mol 电子,理论上生成20.7 g Pb | |
| D. | 该电池总反应为 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com