
科目: 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。右图为苯氧乙酸的结构简式。
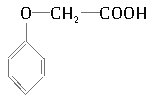
(1)甲一定含有的官能团的名称是___________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不
含甲基,且为链状结构,其结构简式是______________(碳碳双键上连有羟基的结构不稳定)
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有两种一硝基取代物的同分异构体是(写出任意两种的结构简式)____________________ ________________
(4)已知:
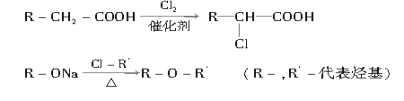
菠萝酯的合成路线如下:
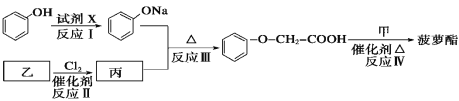
①试剂X不可选用的是(选填字母)________。
a. Na2CO3溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是__________________,反应Ⅱ的反应类型是____________。
③反应Ⅳ的化学方程式是_________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】达比加群酯,是由德国公司开发的新型口服抗凝血药物,针对急性和慢性血栓栓塞性疾病的预防及治疗。F是其合成过程中的重要中间体,以下是F的合成路线图:(-Me表示甲基)

(1)写出A中含氧官能团的名称:_________和__________。
(2)B→C的反应类型是______________________。
(3)写出C→D转化的化学方程式__________________________。
(4)写出符合条件的B的同分异构体的结构简式_________________。
①属于芳香族化合物 ②能发生银镜反应 ③分子中只有两种化学环境不同的氢原子
(5)已知:![]()
肉桂酰氯![]() 是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是8种有机化合物的转换关系:
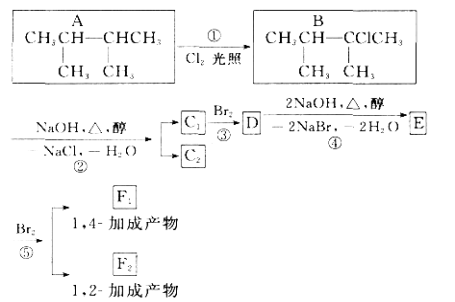
请回答下列问题:
(1)上述框图中,①是________反应,③是________反应(填反应类型)。
(2)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______________________________________________________________。
(3) C 1的结构简式是______________________;F 1的结构简式是_____________________________。
(4) 上述8种化合物中,属于二烯烃的是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂质),制取ZnSO4·7H2O可以采取如下工艺流程:

金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
![]() 回答下列问题:
回答下列问题:
(1)酸溶时常常加入少量的CuSO4,其目的是 。
(2)写出氧化时的离子方程式 。该过程中加入的H2O2量要远多于理论值,原因除了提高另外反应物的转化率外,还可能是 。
(3)调节pH大于8后会造成锌元素转化率降低,其原因是 。
(4)从滤液B获得Na2SO4应该采用的方法是蒸发结晶, ,洗涤干燥。(部分物质的溶解度曲线见下图)

(5)由滤渣B制备ZnSO4·7H2O的实验方案为:_ __ __,干燥得到ZnSO4·7H2O (实验中须使用的试剂有:1mol/LH2SO4,蒸馏水,乙醇;除常用仪器外须使用的仪器有:pH计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲基的电子式 ,氢元素含量最高的烃的分子式______________。
(2)支链只有一个乙基且相对分子质量最小的烷烃的结构简式为
(3)某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃的名称是 (系统命名法命名)
(4)已知某有机物的结构简式为:![]()
①该有机物中所含官能团的名称是________________;_______________。
②写出该有机物使溴水褪色的反应化学方程式_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为
(1)有机物Y是X的同分异构体,且属于芳香烃, Y在一定条件能发生聚合反应,写出其化学方程式____________________________________________ 。
(2)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有___________ 种。
查看答案和解析>>
科目: 来源: 题型:
【题目】【物质结构与性质】
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu(NH3)4]SO4·H2O。
(1)Cu基态核外电子排布式为 。
[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中碳原子轨道杂化类型为 。
与H2O互为等电子体的一种阴离子为 (填化学式)。
(3)[Cu(NH3)4]SO4·H2O含有 。(填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.氢键
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。
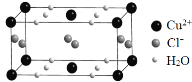
查看答案和解析>>
科目: 来源: 题型:
【题目】溴乙烷是一种重要的液体化工原料,沸点38.4 ℃,难溶于水且为非电解质,可与碱溶液反应。实验室中可利用如下原理制取少量溴乙烷:
H2SO4(浓)+NaBr+C2H5OH→C2H5Br+NaHSO4。
某研究性学习小组的同学设计了如图所示的装置(支持及加热仪器已省略)来制备溴乙烷,并验证有副产物SO2、CO2、C2H4生成(SO2沸点10 ℃)。

(1)仪器B的名称是________,装置D用来检验并除去乙烯,则D中的试剂是________,F的用途是_____________________________________________________,证明一定有CO2生成的现象是__________________________________。
(2)C中所得到的溴乙烷中含有少量的乙醇、Br2、HBr。为得到纯净的溴乙烷,该同学取出C中的液体依次用水洗→___________洗→水洗,再用__________干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是__________。
(3)假设上述实验都得到了预期的实验现象,写出乙醇与浓硫酸反应生成上述无机气体时的化学方程式:___________________________________。
(4)小组的同学对产品有存在溴单质的原因及验证方法进行了分析讨论。
①含有溴单质的依据是__________________________________。
②请设计一种实验方案,利用化学方法证明C中的液体中含有单质溴:_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]某绿色农药结构简式为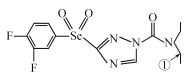 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)__________________(用元素符号回答,下同),基态硒原子的价层电子排布式为________________________。
(2)该物质中杂化轨道类型为sp2的原子有__________,分子内,分子中编号为①的碳原子和与其成键另外几个原子构成的空间结构为_____________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH4<C2H6<CH3OH,其原因是_______________________________________,三种物质中属于极性分子的物质是__________,与CH4互为等电子体的一种微粒是______。
(4)硒化锌的晶胞结构如图所示,则硒的配位数为_______,若晶胞边长为d pm,设阿伏加德罗常数的值为NA,则硒化锌的密度为____________(不必化简)。
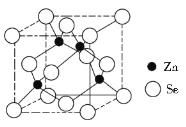
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com