
科目: 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式:_______________。
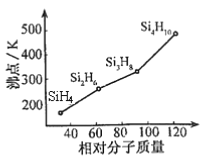
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取____杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________。
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为_______。 (用元素符号表示)
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种离子为____________(填化学式)。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_________;若该晶体的晶胞棱长为a pm,则该合金密度为______g/cm 3。(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化钙可用于石油钻井,也可用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr22H2O的主要流程如下:

工业提取液溴主要采用空气吹出法,其主要流程如下:

请回答:
(1)Fe与液溴的反应温度不能超过40℃的原因是_________。
(2)试剂B最好选用_________。
(3)操作Ⅰ的步骤为蒸发浓缩、、________、洗涤、干燥。
(4)下列说法中错误的是_________。
a.滤渣A的成分可能是Fe、Fe(OH)2 、Fe(OH)3;
b.操作Ⅱ的名称是萃取
c.流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr22H2O可以通过以下方法测定纯度:称取5.00 g样品溶于水,滴入足量Na2CO3溶液,充分反应后抽滤,将沉淀洗涤、烘干、冷却、称量,得到2.00 g固体。
①抽滤时用到的仪器除了安全瓶、抽气泵外,还需要_____________________________。
②抽滤中洗涤沉淀的操作方法是_________。
③以下关于抽滤的操作不正确的是________________
A.放在布氏漏斗内的滤纸大小应略小于漏斗内径,但又能将全部小孔盖住
B.过滤时,溶液量不应超过漏斗容量的2/3
C.吸滤瓶内液面将达到支管口时,应拔掉抽滤瓶上的橡皮管,从支管口处倒出溶液
D.停止吸滤时,应先拆下连接抽气泵和抽滤瓶的橡皮管,然后关闭水龙头
④测得CaBr22H2O的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是

A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
查看答案和解析>>
科目: 来源: 题型:
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
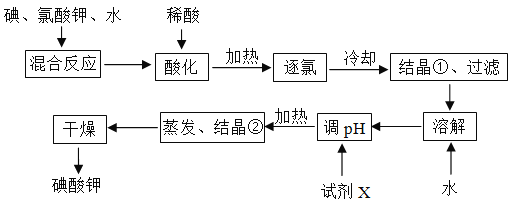
(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某硫化锌精矿的主要成分为ZnS(还含少量 FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是__________________,反应的离子方程式为____________________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用 Pb-Ag 合金惰性电极,阳极逸出的气体是___________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________。
(6)硫化锌精矿(ZnS)遇到硫酸铜溶液可慢慢地转变为铜蓝(CuS)。请用简短的语言解释该反应发生的原理_______________________。
(7)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目: 来源: 题型:
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
科目: 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
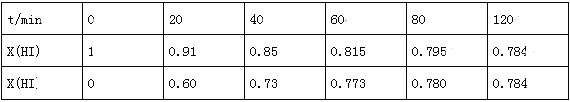
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
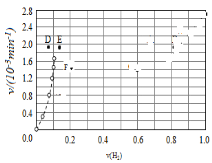
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。

查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:

CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为

回答下列问题:
(1)A的分子式为 。
(2)A可能发生的化学反应有 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是 mol,燃烧产物的平均摩尔质量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com