
科目: 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A 可能是下列物质中的( )
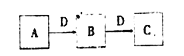
①金属钠 ②硫单质 ③NH3④Na2C03⑤AlCl3溶液 ⑥单质铁
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.用硫氰化钾溶液检验Fe3+:Fe3++3SCN﹣![]() Fe(SCN)3↓
Fe(SCN)3↓
B.向海带灰浸出液中加入稀硫酸、双氧水:2I﹣+2H++H2O2![]() I2+2H2O
I2+2H2O
C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH﹣![]() Na2SiO3↓+H2O
Na2SiO3↓+H2O
D.NaHCO3溶液和少量Ba(OH)2溶液混合:+OH﹣+Ba2+![]() H2O+BaCO3↓
H2O+BaCO3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl- 六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 该反应的还原剂是Cl-
B. 消耗1 mol还原剂,转移6 mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 反应后溶液的酸性明显增强
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
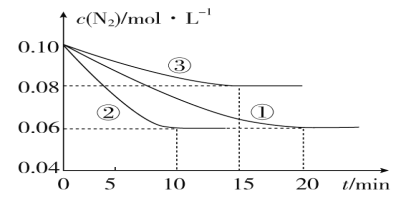
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的________、________(填字母编号)。
a.增大压强 b.减小压强
c.升高温度 d.降低温度
e.使用催化剂
(2)800 K时向下列起始体积相同的密闭容器中充入2 mol N2、3 mol H2,甲容器在反应过程中保持温度压强不变,乙容器保持温度体积不变,丙容器是绝热容器保持体积不变,三容器各自建立化学平衡。
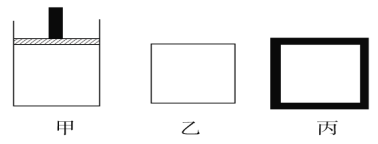
①达到平衡时,平衡常数K甲________K乙________K丙(填“>”“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲________c(N2)乙,c(N2)乙________c(N2)丙(填“>”“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是____________。
A.甲容器气体密度不再变化时,说明此反应已达到平衡状态
B.在乙中充入稀有气体He,化学反应速率加快
C.丙容器温度不再变化时说明已达平衡状态
D.向丙容器中充入氨气,正向速率减小,逆向速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列说法的判断正确的是
A. 漂白粉在空气中不稳定,可用于漂白纸张
B. 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质
C.NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验
D. 打磨磁石制指南针不涉及化学反应
查看答案和解析>>
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X离子的氧化性比Y离子氧化性强
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D. W单质的氧化性比Z单质强
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z是原子序数依次增大的同一周期主族元素,W、X是金属,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______。
(2)W与Y可形成化合物W2Y,该化合物的电子式为______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为______________。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是___>____>____>____。
(5)Z的最高价氧化物为无色液体,该物质与水可发生反应。写出该反应的化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 molL﹣1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)

(1)A、B、C、D的第一电离能由小到大的顺序为____________________________。
(2)C的氢化物分子是 (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是 。中心原子的杂化方式为 。
(4)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如上图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com