
科目: 来源: 题型:
【题目】海藻中含有丰富的以离子形式存在的碘元素。下图是实验室从海藻中提取碘的流程的一部分。
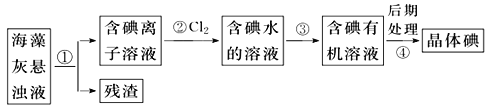
下列判断正确的是( )
A. 步骤①、③的操作分别是过滤、萃取
B. 可用硝酸银溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或四氯化碳
D. 步骤④的操作是过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
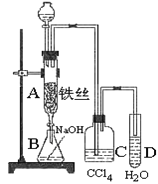
(1)写出A中反应的化学方程式_____________;
(2)观察到A中的现象是_____________;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____________,写出有关反应的离子方程式_____________;
(4)C中盛放CCl4的作用是_____________;
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_____________,现象是_____________。
查看答案和解析>>
科目: 来源: 题型:
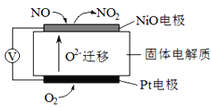
【题目】2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注。大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质。大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动。
I、通过NOx传感器可监测空气的NOx的含量,其工作原理图如下图,写出NiO电极的电极反应式__________________;
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-l59.5kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJmol-1
③H2O(l)=H2O(g) △H=+44.0kJmol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式____________;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡。此时NH3的浓度为0.8mol/L,则CO2的反应速率为________,NH3的转化率是________。
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染。已知:
反应a:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
反应c: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图所示。下列说法正确的是________________。
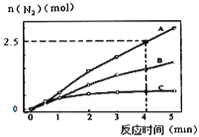
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有_______________(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数_______(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如图。下列有关叙述正确的是

A.亮菌甲素中含有四种官能团
B.每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子
C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗3molNaOH
D.亮菌甲素能与Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液都能发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是

A. 相对于途径①,途径②更好地体现了绿色化学思想
B. Y可以是葡萄糖溶液
C. 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1 mol
D. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述不正确的是( )
A.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA
B.1 mol Cu和足量热浓硫酸反应可生成NA 个SO3分子
C.3 mol单质Fe完全转变为Fe3O4,失去8NA电子
D.1mol铁和氯气完全反应时转移的电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)

已知:装置Ⅰ中生成乙烯的化学方程式 为C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(1)写出乙烯的电子式 。
(2)溶液“变棕黑”,说明浓硫酸具有 性。
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,不一定是加成反应
C.使溴水褪色的物质,不一定是乙烯
(4)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是 ,发生的反应方程式为 。
(5)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为 ,B中的试剂为 。

(6)写出乙醇在铜催化下氧化的方程式 。
查看答案和解析>>
科目: 来源: 题型:
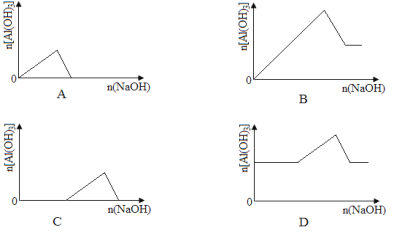
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
查看答案和解析>>
科目: 来源: 题型:
【题目】 四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期、第ⅥA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com