
科目: 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。

根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为____________________
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写2种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组利用以下装置制备氨气、氯气以及LiH固体。
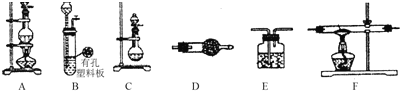
(1)为制备干燥的氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内加入的固体宜选用________;(填选项字母)
a.生石灰 b.氯化钙 c.五氧化二磷
(2)连接装置A、E、E可制取纯净、干燥的氯气,则两个E装置内的药品依次________;装置A中发生反应的离子方程式为________________;
(3)该小组准备利用上述部分装置制备LiH固体.可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰.已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能引起燃烧.设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是________________(不必写出具体的操作方法);加入药品后,其中装置D的作用是________________。
②加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处.采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险.完成LiH与水反应的化学方程_______;
③准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是( )
A.生成的乙酸乙酯中含有18O
B.生成的水分子中不含18O
C.可能生成44g乙酸乙酯
D.可能生成90g乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A.NH3易液化,常用作制冷剂
B.NH4Cl中含有少量的I2可通过加热的方法除去
C.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.浓硝酸需保存在棕色瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,则该元素位于周期( )
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣA族 D. 第3周期ⅣB族
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | Y | Z | |
X | 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.白炽灯工作时,电能全部转化为光能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法正确的是
A.氮的固定是指将气态氮气变为固态
B.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属”
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是

A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com